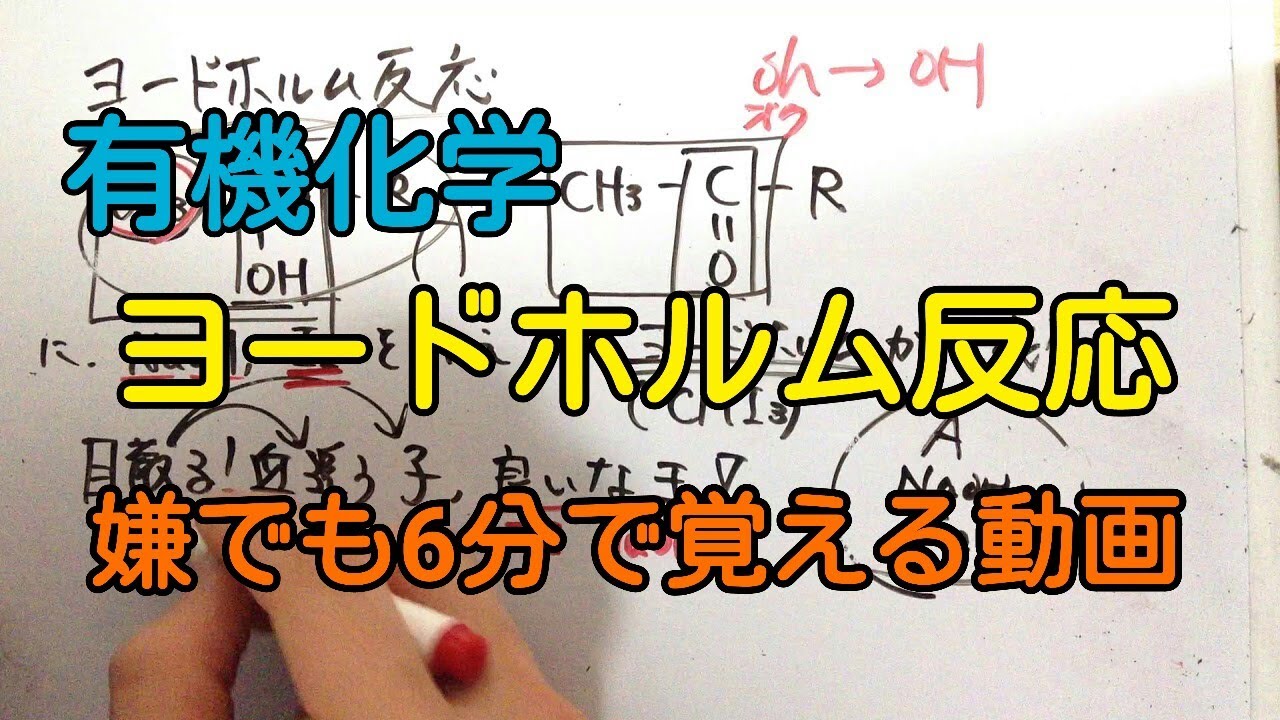
問題文全文(内容文):
必要があれば,次の値を使うこと。
原子量 $H 1.0 C 12 O 16 Na 23$
問 不純物を含む炭酸ナトリウムの粉末 1.0g を純水に溶解して,正確に 200mL の水溶液を調製した。
この水溶液から 20mL をコニカルビーカーにはかり取って,指示薬としてフェノールフタレインを数滴加えた。
はかり取った水溶液を 0.10mol/L の塩酸で滴定したところ,8.0mL 滴下したところで水溶液の色が $\boxed{ア}$ に変化したので,1 回目の中和点とした。
次に,指示薬としてメチルオレンジを数滴加えて,0.10mol/L の塩酸で続けて滴定したところ,さらに $\boxed{A}$ mL 滴下した
ところで,水溶液の色が $\boxed{イ} $に変化したので,2 回目の中和点とした。
次の(1)~(3)に答えなさい。
ただし,不純物は反応に関与しないものとする。
(1) 空欄 $\boxed{ア} , \boxed{イ}$ にあてはまる色の変化の組合せとして正しいものを,次の a~d のうちから一つ選びなさい。
a 赤色から無色(ア) 赤色から黄色(イ)
b 赤色から無色(ア) 黄色から赤色(イ)
c 無色から赤色(ア) 赤色から黄色(イ)
d 無色から赤色(ア) 黄色から赤色(イ)
(2) 空欄 $\boxed{A}$ にあてはまる数値として最も適当なものを,次の a~e のうちから一つ選びなさい。
a 2.0 b 4.0 c 8.0 d 12 e 16
(3) この粉末中の炭酸ナトリウムの純度〔質量%〕は何%か。
有効数字 2 桁で答えなさい。
必要があれば,次の値を使うこと。
原子量 $H 1.0 C 12 O 16 Na 23$
問 不純物を含む炭酸ナトリウムの粉末 1.0g を純水に溶解して,正確に 200mL の水溶液を調製した。
この水溶液から 20mL をコニカルビーカーにはかり取って,指示薬としてフェノールフタレインを数滴加えた。
はかり取った水溶液を 0.10mol/L の塩酸で滴定したところ,8.0mL 滴下したところで水溶液の色が $\boxed{ア}$ に変化したので,1 回目の中和点とした。
次に,指示薬としてメチルオレンジを数滴加えて,0.10mol/L の塩酸で続けて滴定したところ,さらに $\boxed{A}$ mL 滴下した
ところで,水溶液の色が $\boxed{イ} $に変化したので,2 回目の中和点とした。
次の(1)~(3)に答えなさい。
ただし,不純物は反応に関与しないものとする。
(1) 空欄 $\boxed{ア} , \boxed{イ}$ にあてはまる色の変化の組合せとして正しいものを,次の a~d のうちから一つ選びなさい。
a 赤色から無色(ア) 赤色から黄色(イ)
b 赤色から無色(ア) 黄色から赤色(イ)
c 無色から赤色(ア) 赤色から黄色(イ)
d 無色から赤色(ア) 黄色から赤色(イ)
(2) 空欄 $\boxed{A}$ にあてはまる数値として最も適当なものを,次の a~e のうちから一つ選びなさい。
a 2.0 b 4.0 c 8.0 d 12 e 16
(3) この粉末中の炭酸ナトリウムの純度〔質量%〕は何%か。
有効数字 2 桁で答えなさい。
単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#中和と塩#理科(高校生)#大阪医科薬科大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
必要があれば,次の値を使うこと。
原子量 $H 1.0 C 12 O 16 Na 23$
問 不純物を含む炭酸ナトリウムの粉末 1.0g を純水に溶解して,正確に 200mL の水溶液を調製した。
この水溶液から 20mL をコニカルビーカーにはかり取って,指示薬としてフェノールフタレインを数滴加えた。
はかり取った水溶液を 0.10mol/L の塩酸で滴定したところ,8.0mL 滴下したところで水溶液の色が $\boxed{ア}$ に変化したので,1 回目の中和点とした。
次に,指示薬としてメチルオレンジを数滴加えて,0.10mol/L の塩酸で続けて滴定したところ,さらに $\boxed{A}$ mL 滴下した
ところで,水溶液の色が $\boxed{イ} $に変化したので,2 回目の中和点とした。
次の(1)~(3)に答えなさい。
ただし,不純物は反応に関与しないものとする。
(1) 空欄 $\boxed{ア} , \boxed{イ}$ にあてはまる色の変化の組合せとして正しいものを,次の a~d のうちから一つ選びなさい。
a 赤色から無色(ア) 赤色から黄色(イ)
b 赤色から無色(ア) 黄色から赤色(イ)
c 無色から赤色(ア) 赤色から黄色(イ)
d 無色から赤色(ア) 黄色から赤色(イ)
(2) 空欄 $\boxed{A}$ にあてはまる数値として最も適当なものを,次の a~e のうちから一つ選びなさい。
a 2.0 b 4.0 c 8.0 d 12 e 16
(3) この粉末中の炭酸ナトリウムの純度〔質量%〕は何%か。
有効数字 2 桁で答えなさい。
必要があれば,次の値を使うこと。
原子量 $H 1.0 C 12 O 16 Na 23$
問 不純物を含む炭酸ナトリウムの粉末 1.0g を純水に溶解して,正確に 200mL の水溶液を調製した。
この水溶液から 20mL をコニカルビーカーにはかり取って,指示薬としてフェノールフタレインを数滴加えた。
はかり取った水溶液を 0.10mol/L の塩酸で滴定したところ,8.0mL 滴下したところで水溶液の色が $\boxed{ア}$ に変化したので,1 回目の中和点とした。
次に,指示薬としてメチルオレンジを数滴加えて,0.10mol/L の塩酸で続けて滴定したところ,さらに $\boxed{A}$ mL 滴下した
ところで,水溶液の色が $\boxed{イ} $に変化したので,2 回目の中和点とした。
次の(1)~(3)に答えなさい。
ただし,不純物は反応に関与しないものとする。
(1) 空欄 $\boxed{ア} , \boxed{イ}$ にあてはまる色の変化の組合せとして正しいものを,次の a~d のうちから一つ選びなさい。
a 赤色から無色(ア) 赤色から黄色(イ)
b 赤色から無色(ア) 黄色から赤色(イ)
c 無色から赤色(ア) 赤色から黄色(イ)
d 無色から赤色(ア) 黄色から赤色(イ)
(2) 空欄 $\boxed{A}$ にあてはまる数値として最も適当なものを,次の a~e のうちから一つ選びなさい。
a 2.0 b 4.0 c 8.0 d 12 e 16
(3) この粉末中の炭酸ナトリウムの純度〔質量%〕は何%か。
有効数字 2 桁で答えなさい。
投稿日:2023.02.10