 ぺんぎん高校化学問題集
ぺんぎん高校化学問題集
 ぺんぎん高校化学問題集
ぺんぎん高校化学問題集
※下の画像部分をクリックすると、先生の紹介ページにリンクします。
共通テスト追試 化学 2023年度 第4問 問4b エステルの加水分解の量的関係問題

単元:
#化学#有機#大学入試過去問(化学)#酸素を含む脂肪族化合物#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ある植物の葉には、炭素、水素、酸素のみからなるエステルAが含まれている。
$49.0mg$のAを完全に加水分解すると、カルボン酸Bと、分子式 $C_{10}H_{18}O$の1価アルコールC $38.5mg$が得られた。
Bの示性式として最も適当なものを、次の①~④のうちから一つ選べ。
①$CH_3COOH$
②$CH_3CH_2COOH$
③$HOOC-COOH$
④$HOOC-CH_2-COOH$
この動画を見る
ある植物の葉には、炭素、水素、酸素のみからなるエステルAが含まれている。
$49.0mg$のAを完全に加水分解すると、カルボン酸Bと、分子式 $C_{10}H_{18}O$の1価アルコールC $38.5mg$が得られた。
Bの示性式として最も適当なものを、次の①~④のうちから一つ選べ。
①$CH_3COOH$
②$CH_3CH_2COOH$
③$HOOC-COOH$
④$HOOC-CH_2-COOH$
有機化学 命名問題 この物質の名前は?

共通テスト追試 化学 2023年度 第4問 問3 付加重合で得られる高分子化合物についての簡単な計算問題

単元:
#化学#大学入試過去問(化学)#共通テスト#化学(高分子)#合成樹脂とゴム#合成繊維と天然繊維#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
単量体A$(CH_2=CHC_6H_5)$と単量体B$(CH_2=CHCN)$を反応させることで、共重合体を合成した。
この共重合体中のベンゼン環に結合した水素原子と、それ以外の水素原子の総数の比は、$5:4$であった。
このとき反応した単量体AとBの物質量の比として最も適当なものを、次の①~⑤のうちから一つ選べ。
①$1:3$
②$4:5$
③$1:1$
④$5:4$
⑤$3:1$
この動画を見る
単量体A$(CH_2=CHC_6H_5)$と単量体B$(CH_2=CHCN)$を反応させることで、共重合体を合成した。
この共重合体中のベンゼン環に結合した水素原子と、それ以外の水素原子の総数の比は、$5:4$であった。
このとき反応した単量体AとBの物質量の比として最も適当なものを、次の①~⑤のうちから一つ選べ。
①$1:3$
②$4:5$
③$1:1$
④$5:4$
⑤$3:1$
無機化学第8回 硫黄の単体と化合物 まずは硫化水素と二酸化硫黄

有機化学第10回 アルキン(2) アセチレンの付加反応が中心です

化学基礎の教科書を解説する動画 第53回 酸化数の数え方

共通テスト追試 化学 2023年度 第3問 問4b 酸化物の質量測定やイオン交換樹脂を利用した中和滴定からCu²⁺の量を求める

単元:
#化学#大学入試過去問(化学)#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
純粋な硫酸銅(II)五水和物 $CuSO_4.5H_2O$を$102℃$で
長時間加熱すると三水和物 $CuSO_4.3H_2O$が得られるが、
水和水は加熱中に徐々に失われていく。
そのため、試料全体で平均した組成を化学式 $CuSO_4・xH_2O$で表すと、 $102℃$で加熱した試料では、$x$は$3 \leqq x \leqq 5$を満たす実数となる。
また、さら に高温($150℃$以上)で加熱すると、$x$は$0$まで減少し、硫酸銅(II)無水塩 $CuSO_4$(式量160)が得られる。
加熱により、一部の水和水を失った試料Aがある。
試料Aの化学式$CuSO_4・xH_2O$における$x$の値を求めるための実験について、次の問い (a・b)に答えよ。
ただし、試料中には$Cu^{2+}, SO_4^{2-}$と水和水以外は含ま れないものとする。
b 試料Aにおける$x$の値は、$SO_4^{2-}$の含有量の代わりに、$Cu^{2+}$ の含有量を用いて求めることもできる。
試料A中の$Cu^{2+}$含有量を調べる2通りの手法として、
次の実験Ⅱおよび実験Ⅲを考えた。
実験Ⅱ $Cu^{2+}$を含む水溶液に、水酸化ナトリウム $NaOH$水溶液を十分に加え、生じる沈殿をすべてろ過により取り出し、十分に加熱して純粋な酸化銅(Ⅱ)$CuO$(式量 80)としてから、その質量を求める。
実験Ⅲ $Cu^{2+}$を含む水溶液を、陽イオン交換樹脂を詰めたカラムに通し、 流出液に含まれる水素イオン$H^{+}$の物質量を、中和滴定により求める。
ある質量の試料Aを溶かした水溶液Bを用意し、その$10mL$を用いて実験Ⅱを行ったところ、質量$w (mg)$の$CuO$が得られた。
また、別の$10mL$ の水溶液Bを用いて実験Ⅲを行ったところ、濃度$c(mol/L)$の$NaOH$水溶液が、中和滴定の終点までに$V (mL)$必要であった。
用いた水溶液B中の$Cu^{2+}$が、実験Ⅱではすべて$CuO$となり、実験Ⅲではすべて陽イオン交換樹脂により$H^{+}$に交換されたものとすると、求められる$Cu^{2+}$の含有量の値は、実験Ⅱと実験Ⅲで同じ値となる。
このとき、$w、c、V$の値の関係はどのような式で表されるか。
最も適当なものを、次の①~⑥のうちから一つ選べ。
①$V=\displaystyle \frac{25w}{c}$
②$V=\displaystyle \frac{25w}{2c}$
③$V=\displaystyle \frac{25w}{4c}$
④$V=\displaystyle \frac{w}{40c}$
⑤$V=\displaystyle \frac{w}{80c}$
⑥$V=\displaystyle \frac{w}{160c}$
この動画を見る
純粋な硫酸銅(II)五水和物 $CuSO_4.5H_2O$を$102℃$で
長時間加熱すると三水和物 $CuSO_4.3H_2O$が得られるが、
水和水は加熱中に徐々に失われていく。
そのため、試料全体で平均した組成を化学式 $CuSO_4・xH_2O$で表すと、 $102℃$で加熱した試料では、$x$は$3 \leqq x \leqq 5$を満たす実数となる。
また、さら に高温($150℃$以上)で加熱すると、$x$は$0$まで減少し、硫酸銅(II)無水塩 $CuSO_4$(式量160)が得られる。
加熱により、一部の水和水を失った試料Aがある。
試料Aの化学式$CuSO_4・xH_2O$における$x$の値を求めるための実験について、次の問い (a・b)に答えよ。
ただし、試料中には$Cu^{2+}, SO_4^{2-}$と水和水以外は含ま れないものとする。
b 試料Aにおける$x$の値は、$SO_4^{2-}$の含有量の代わりに、$Cu^{2+}$ の含有量を用いて求めることもできる。
試料A中の$Cu^{2+}$含有量を調べる2通りの手法として、
次の実験Ⅱおよび実験Ⅲを考えた。
実験Ⅱ $Cu^{2+}$を含む水溶液に、水酸化ナトリウム $NaOH$水溶液を十分に加え、生じる沈殿をすべてろ過により取り出し、十分に加熱して純粋な酸化銅(Ⅱ)$CuO$(式量 80)としてから、その質量を求める。
実験Ⅲ $Cu^{2+}$を含む水溶液を、陽イオン交換樹脂を詰めたカラムに通し、 流出液に含まれる水素イオン$H^{+}$の物質量を、中和滴定により求める。
ある質量の試料Aを溶かした水溶液Bを用意し、その$10mL$を用いて実験Ⅱを行ったところ、質量$w (mg)$の$CuO$が得られた。
また、別の$10mL$ の水溶液Bを用いて実験Ⅲを行ったところ、濃度$c(mol/L)$の$NaOH$水溶液が、中和滴定の終点までに$V (mL)$必要であった。
用いた水溶液B中の$Cu^{2+}$が、実験Ⅱではすべて$CuO$となり、実験Ⅲではすべて陽イオン交換樹脂により$H^{+}$に交換されたものとすると、求められる$Cu^{2+}$の含有量の値は、実験Ⅱと実験Ⅲで同じ値となる。
このとき、$w、c、V$の値の関係はどのような式で表されるか。
最も適当なものを、次の①~⑥のうちから一つ選べ。
①$V=\displaystyle \frac{25w}{c}$
②$V=\displaystyle \frac{25w}{2c}$
③$V=\displaystyle \frac{25w}{4c}$
④$V=\displaystyle \frac{w}{40c}$
⑤$V=\displaystyle \frac{w}{80c}$
⑥$V=\displaystyle \frac{w}{160c}$
共通テスト(旧センター試験)過去問解説 化学 2015年 第5問 問3 ビニロンのアセタール化比率の計算

単元:
#化学#大学入試過去問(化学)#共通テスト#化学(高分子)#合成繊維と天然繊維#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図1に示すように、ポリビニルアルコール(繰り返し単位〔$+CHOH-CH_2$〕の式量44)をホルムアルデヒドの水溶液で処理すると、ヒドロキシ基の一部がアセタール化されて、ビニロンが得られる。
ヒドロキシ基の$50%$がアセタール化される場合、ポリビニルアルコール$88g$から得られるビニロンは何$g$か。
最も適当な数値を、下の①~⑥のうちから一つ選べ。
①$91$ ②$94$ ③$96$ ④$98$ ⑤$100$ ⑥$102$
※図は動画内参照
この動画を見る
図1に示すように、ポリビニルアルコール(繰り返し単位〔$+CHOH-CH_2$〕の式量44)をホルムアルデヒドの水溶液で処理すると、ヒドロキシ基の一部がアセタール化されて、ビニロンが得られる。
ヒドロキシ基の$50%$がアセタール化される場合、ポリビニルアルコール$88g$から得られるビニロンは何$g$か。
最も適当な数値を、下の①~⑥のうちから一つ選べ。
①$91$ ②$94$ ③$96$ ④$98$ ⑤$100$ ⑥$102$
※図は動画内参照
共通テスト追試 化学 2023年度 第3問 問4a BaSO₄の沈殿反応を利用したSO₄²⁻の定量問題

単元:
#化学#大学入試過去問(化学)#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
純粋な硫酸銅(II)五水和物 $CuSO_4.5H_2O$を$102℃$で
長時間加熱すると三水和物 $CuSO_4.3H_2O$が得られるが、
水和水は加熱中に徐々に失われていく。
そのため、試料全体で平均した組成を化学式 $CuSO_4・xH_2O$で表すと、 $102℃$で加熱した試料では、$x$は$3 \leqq x \leqq 5$を満たす実数となる。
また、さら に高温($150℃$以上)で加熱すると、$x$は$0$まで減少し、硫酸銅(II)無水塩 $CuSO_4$(式量160)が得られる。
加熱により、一部の水和水を失った試料Aがある。
試料Aの化学式$CuSO_4・xH_2O$における$x$の値を求めるための実験について、次の問い (a・b)に答えよ。
ただし、試料中には$Cu^{2+}, SO_4^{2-}$と水和水以外は含ま れないものとする。
a 試料中の$SO_4^{2-}$ 含有量からxの値を求めるために、
次の実験Ⅰを行った。
実験Ⅰ $1.178g$の試料Aを水に完全に溶かし、塩化バリウム $BaCl_2$水溶液を硫酸バリウム$BaSO_4$(式量 233)の白色沈殿が新たに生じなくなるまで徐々に加えた。
白色沈殿をすべてろ過により取り出し、洗浄、乾燥して質量を求めたところ、$1.165g$であった。
$1.178g$の試料中の$SO_2$がすべて白色沈殿に含まれたと仮定すると、 $x$の値はいくらか。
$x$を小数第1位までの数値として次の形式で表すとき、
$\boxed{ 16 }$ と$\boxed{ 17 }$に当てはまる数字を、
後の①~⓪のうちから一つずつ選べ。
ただし、同じものを繰り返し選んでもよい。
$x =\boxed{ 16 },\boxed{ 17 }$
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$
⑥$6$ ⑦$7$ ⑧$8$ ⑨$9$ ⓪$0$
この動画を見る
純粋な硫酸銅(II)五水和物 $CuSO_4.5H_2O$を$102℃$で
長時間加熱すると三水和物 $CuSO_4.3H_2O$が得られるが、
水和水は加熱中に徐々に失われていく。
そのため、試料全体で平均した組成を化学式 $CuSO_4・xH_2O$で表すと、 $102℃$で加熱した試料では、$x$は$3 \leqq x \leqq 5$を満たす実数となる。
また、さら に高温($150℃$以上)で加熱すると、$x$は$0$まで減少し、硫酸銅(II)無水塩 $CuSO_4$(式量160)が得られる。
加熱により、一部の水和水を失った試料Aがある。
試料Aの化学式$CuSO_4・xH_2O$における$x$の値を求めるための実験について、次の問い (a・b)に答えよ。
ただし、試料中には$Cu^{2+}, SO_4^{2-}$と水和水以外は含ま れないものとする。
a 試料中の$SO_4^{2-}$ 含有量からxの値を求めるために、
次の実験Ⅰを行った。
実験Ⅰ $1.178g$の試料Aを水に完全に溶かし、塩化バリウム $BaCl_2$水溶液を硫酸バリウム$BaSO_4$(式量 233)の白色沈殿が新たに生じなくなるまで徐々に加えた。
白色沈殿をすべてろ過により取り出し、洗浄、乾燥して質量を求めたところ、$1.165g$であった。
$1.178g$の試料中の$SO_2$がすべて白色沈殿に含まれたと仮定すると、 $x$の値はいくらか。
$x$を小数第1位までの数値として次の形式で表すとき、
$\boxed{ 16 }$ と$\boxed{ 17 }$に当てはまる数字を、
後の①~⓪のうちから一つずつ選べ。
ただし、同じものを繰り返し選んでもよい。
$x =\boxed{ 16 },\boxed{ 17 }$
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$
⑥$6$ ⑦$7$ ⑧$8$ ⑨$9$ ⓪$0$
共通テスト追試 化学 2023年度 第2問 問4b ヘスの法則の計算問題

単元:
#化学#化学理論#大学入試過去問(化学)#物質の変化と熱・光#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
炭素数が4以上の直鎖状のアルカンでは、図3に示すように、
炭素数が1増えると$CH_2$どうしによる$C-C$単結合も一つ増える。
そのため、気体のアルカンの生成熱や燃焼熱を炭素数に対してグラフにすると、$n$が大きくなると直線になることが知られている。
いくつかの直鎖状のアルカンおよび$CO_2$(気)と$H_2O$(気)の$25℃$における生成熱を表に示す。
この温度における直鎖状のアルカン$C_8H_{18}$(気)の燃焼熱は何$kJ/mol$か。
最も適当な数値を、後の①~⑤のうちから一つ選べ。
ただし、生成する$H_2O$は気体である。
必要があれば方眼紙を使うこと。
①$2.09 \times 10^2$
②$4.69 \times 10^2$
③$5.12 \times 10^3$
④$5.15 \times 10^3$
⑤$5.27 \times 10^3$
※図・表は動画内参照
この動画を見る
炭素数が4以上の直鎖状のアルカンでは、図3に示すように、
炭素数が1増えると$CH_2$どうしによる$C-C$単結合も一つ増える。
そのため、気体のアルカンの生成熱や燃焼熱を炭素数に対してグラフにすると、$n$が大きくなると直線になることが知られている。
いくつかの直鎖状のアルカンおよび$CO_2$(気)と$H_2O$(気)の$25℃$における生成熱を表に示す。
この温度における直鎖状のアルカン$C_8H_{18}$(気)の燃焼熱は何$kJ/mol$か。
最も適当な数値を、後の①~⑤のうちから一つ選べ。
ただし、生成する$H_2O$は気体である。
必要があれば方眼紙を使うこと。
①$2.09 \times 10^2$
②$4.69 \times 10^2$
③$5.12 \times 10^3$
④$5.15 \times 10^3$
⑤$5.27 \times 10^3$
※図・表は動画内参照
無機化学第7回 酸素と酸素化合物 半分くらい理論化学の復習です

有機化学第9回 アルキン(1)

化学基礎の教科書を解説する動画 第52回 酸化数

単元:
#化学#化学基礎2ー物質の変化#酸化還元反応#理科(高校生)
指導講師:
共通テスト「情報I」 専門チャンネルぺんぎん高校化学問題集
問題文全文(内容文):
化学基礎 教科書の解説
〔酸化数〕
この動画を見る
化学基礎 教科書の解説
〔酸化数〕
共通テスト(旧センター試験)過去問解説 化学 2015年 第5問 問2 ナイロン66の構造式

単元:
#化学#大学入試過去問(化学)#共通テスト#化学(高分子)#合成繊維と天然繊維#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ナイロン66(6.6-ナイロン)の構造として正しいものを次の①~⑥のうちから一つ選べ。
※図は動画内参照
この動画を見る
ナイロン66(6.6-ナイロン)の構造として正しいものを次の①~⑥のうちから一つ選べ。
※図は動画内参照
共通テスト追試 化学 2023年度 第2問 問4a カイロの発熱量

単元:
#その他#その他
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
白金触媒式カイロは、図2に示すように、液体のアルカンを燃料とし、蒸発 したアルカンが白金触媒表面上で酸素により酸化される反応(酸化反応)の発熱を利用して暖をとる器具である。
この反応の反応熱(燃焼熱)を$Q(kJ/mol)$とし、直鎖状のアルカンであるヘプタン$C_7H_{16}$ (分子量100)を例にとると、熱化学方程式は次の式(5)で表される。
$C_7H_{16}$(気)$+110_2$(気) $= 7CO_2$(気) $+ 8H_2O$(気)$+QkJ$ (5)
アルカンの酸化反応に関する次の問い(a・b)に答えよ。
a 白金触媒式カイロを使用して暖をとるために利用できる熱量を、式(5)や状態変化で出入りする熱量から求めたい。
実際のカイロでは白金触媒は約$200℃$になっているが、その温度での反応を考えなくてよい。
気温$5℃$でカイロを使用し始め、生成物の温度が最終的に$25℃$になるとすると、暖をとるために利用できる熱量は$5℃$の$C_7H_{16}$ (液)と$O_2$を$25℃$まで温めるための熱量、$25℃$における $C_7H_{16}$の蒸発熱、$25℃$における反応熱から計算できる。
$5℃$の$C_7H_{16}$(液) $10.0g (0.100 mol)$と$5℃$の$O_2$から出発し、すべての$C_7H_{16}$が反応して$25℃$の$CO_2$と$H_2O$(気)が生成するとき、利用できる熱量は何$kJ$か。
最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、 $C_7H_{16}$ (液)と$O_2$を$5℃$から$25℃$まで温めるために必要な熱量は、$1 mol$ あたりそれぞれ$4.44kJ, 0.600kJ$とし、$25℃$における$C_7H_{16}$の蒸発熱は $36.6 kJ/mol$とする。
また、式(5)で表される$C_7H_{16}$(気)の反応熱は、$25℃$において $4.50 \times 10^3 kJ/mol$とする。
①$4.41 \times 10^2$
②$4.45 \times 10^2$
③$4.50 \times 10^2$
④$4.41 \times 10^3$
⑤$4.45 \times 10^3$
※図は動画内参照
この動画を見る
白金触媒式カイロは、図2に示すように、液体のアルカンを燃料とし、蒸発 したアルカンが白金触媒表面上で酸素により酸化される反応(酸化反応)の発熱を利用して暖をとる器具である。
この反応の反応熱(燃焼熱)を$Q(kJ/mol)$とし、直鎖状のアルカンであるヘプタン$C_7H_{16}$ (分子量100)を例にとると、熱化学方程式は次の式(5)で表される。
$C_7H_{16}$(気)$+110_2$(気) $= 7CO_2$(気) $+ 8H_2O$(気)$+QkJ$ (5)
アルカンの酸化反応に関する次の問い(a・b)に答えよ。
a 白金触媒式カイロを使用して暖をとるために利用できる熱量を、式(5)や状態変化で出入りする熱量から求めたい。
実際のカイロでは白金触媒は約$200℃$になっているが、その温度での反応を考えなくてよい。
気温$5℃$でカイロを使用し始め、生成物の温度が最終的に$25℃$になるとすると、暖をとるために利用できる熱量は$5℃$の$C_7H_{16}$ (液)と$O_2$を$25℃$まで温めるための熱量、$25℃$における $C_7H_{16}$の蒸発熱、$25℃$における反応熱から計算できる。
$5℃$の$C_7H_{16}$(液) $10.0g (0.100 mol)$と$5℃$の$O_2$から出発し、すべての$C_7H_{16}$が反応して$25℃$の$CO_2$と$H_2O$(気)が生成するとき、利用できる熱量は何$kJ$か。
最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、 $C_7H_{16}$ (液)と$O_2$を$5℃$から$25℃$まで温めるために必要な熱量は、$1 mol$ あたりそれぞれ$4.44kJ, 0.600kJ$とし、$25℃$における$C_7H_{16}$の蒸発熱は $36.6 kJ/mol$とする。
また、式(5)で表される$C_7H_{16}$(気)の反応熱は、$25℃$において $4.50 \times 10^3 kJ/mol$とする。
①$4.41 \times 10^2$
②$4.45 \times 10^2$
③$4.50 \times 10^2$
④$4.41 \times 10^3$
⑤$4.45 \times 10^3$
※図は動画内参照
共通テスト追試 化学 2023年度 第2問 問3 2段階電離の電離定数

単元:
#化学#化学理論#化学反応の速さ#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ある2価の酸$H_2A$は、水溶液中では式(2)と(3)で表されるように二段階で電離する。
(2)$H_2A→H^{+}+HA{-}$
(3)$HA^{-}⇄H^{+}+A^{2-}$
式(2)に示した一段落目の反応は$H_2A$は$H^{+}$と$HA^{-}$に完全に電離し、式(3)に示した二段落目の反応では電離平衛状態になる。
式(3)の反応の平衛定数$K$は次の式(4)で表される。
(4)$\displaystyle \frac{〔H^{+}〕〔A^{2-}〕}{〔HA^{-}〕}$
$H_2A$水溶液のモル濃度$c$、二段階目の反応における$HA{-}$の電離度$a$としたとき。$K$を表す式として最も適当なものを、次の①~④のうちから一つ選べ。
①$\displaystyle \frac{ca^2}{1-a}$ ②$\displaystyle \frac{ca(1+a)}{1-a}$ ③$\displaystyle \frac{ca^2}{1+a}$ ④$\displaystyle \frac{ca(1+2a)}{1+a}$
この動画を見る
ある2価の酸$H_2A$は、水溶液中では式(2)と(3)で表されるように二段階で電離する。
(2)$H_2A→H^{+}+HA{-}$
(3)$HA^{-}⇄H^{+}+A^{2-}$
式(2)に示した一段落目の反応は$H_2A$は$H^{+}$と$HA^{-}$に完全に電離し、式(3)に示した二段落目の反応では電離平衛状態になる。
式(3)の反応の平衛定数$K$は次の式(4)で表される。
(4)$\displaystyle \frac{〔H^{+}〕〔A^{2-}〕}{〔HA^{-}〕}$
$H_2A$水溶液のモル濃度$c$、二段階目の反応における$HA{-}$の電離度$a$としたとき。$K$を表す式として最も適当なものを、次の①~④のうちから一つ選べ。
①$\displaystyle \frac{ca^2}{1-a}$ ②$\displaystyle \frac{ca(1+a)}{1-a}$ ③$\displaystyle \frac{ca^2}{1+a}$ ④$\displaystyle \frac{ca(1+2a)}{1+a}$
共通テスト追試 化学 2023年度 第2問 問2 鉛蓄電池の放電に関する計算問題

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
自動車等に用いられる鉛蓄電池は、負極活物質に鉛$Pb$、
正極活物質に酸化鉛(IV)$PbO_{2+}$電解液として希硫酸を用いる。
鉛蓄電池の充電と放電における反応をまとめると次の式(1)で表され、電極の質量が変化するとともに硫酸$H_2SO_4$の濃度が変化する。
(1)$Pb + PbO_2 + 2H_2SO_4 ⇄ 2 PbSO_4 + 2H_2O$
【⇄上部:放電、下部:充電】
濃度 $3.00 mol/L$の硫酸$100mL$を用いた鉛蓄電池を外部回路に接続し、しば らく放電させ、硫酸の濃度が$2.00 mol/L$に低下した。
このとき、外部回路に流れた電気量は何$C$か。
最も適当な数値を次の①~⑥のうちから一つ選べ。
ただし、ファラデー定数は$9.65 \times 10^4C/mol$とし、電極で生じた電子はすべて外部回路を流れたものとする。
また、電極での反応による電解液の体積変化は無視できるものとする。
①$9.65 \times 10^2$
②$1.93 \times 10^2$
③$2.90 \times 10^2$
④$9.65 \times 10^3$
⑤$1.93 \times 10^4$
⑥$2.90 \times 10^4$
この動画を見る
自動車等に用いられる鉛蓄電池は、負極活物質に鉛$Pb$、
正極活物質に酸化鉛(IV)$PbO_{2+}$電解液として希硫酸を用いる。
鉛蓄電池の充電と放電における反応をまとめると次の式(1)で表され、電極の質量が変化するとともに硫酸$H_2SO_4$の濃度が変化する。
(1)$Pb + PbO_2 + 2H_2SO_4 ⇄ 2 PbSO_4 + 2H_2O$
【⇄上部:放電、下部:充電】
濃度 $3.00 mol/L$の硫酸$100mL$を用いた鉛蓄電池を外部回路に接続し、しば らく放電させ、硫酸の濃度が$2.00 mol/L$に低下した。
このとき、外部回路に流れた電気量は何$C$か。
最も適当な数値を次の①~⑥のうちから一つ選べ。
ただし、ファラデー定数は$9.65 \times 10^4C/mol$とし、電極で生じた電子はすべて外部回路を流れたものとする。
また、電極での反応による電解液の体積変化は無視できるものとする。
①$9.65 \times 10^2$
②$1.93 \times 10^2$
③$2.90 \times 10^2$
④$9.65 \times 10^3$
⑤$1.93 \times 10^4$
⑥$2.90 \times 10^4$
無機化学第6回 ハロゲン化合物 ハロゲン化銀の色・水への溶解性は要チェック

有機化学第8回 エチレンの製法・アルケンの酸化

化学基礎の教科書を解説する動画 第51回 酸化の定義

共通テスト追試 化学 2023年度 第1問 問5b 固体の溶解度の問題 最後の罠に気をつけて

単元:
#化学#化学理論#溶液の性質#理科(高校生)#化学#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図1に示す塩化カリウム$KCI$. 硝酸カリウム$KNO_3$, および硫酸マグネシウ$MgSO_4$の水に対する溶解度曲線を用いて、
固体の溶解および析出に関する後の問い(a・b)に答えよ。
b $MgSO_4$の水溶液を冷却して得られる結晶は、$MgSO_4$の水和物である。
水$100g$に、ある量の$MgSO_4$が溶けている水溶液Aを$14℃$に冷却する。
このとき、析出する$MgSO_4$の水和物の質量が$12.3g$であり、その中の水和水の質量が$6.3g$である場合、冷却前の水溶液Aに溶けている$MgSO_4$の質量は何$g$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
①$28$ ②$30$ ③$32$ ④$34$ ⑤$36$ ⑥$42$
※図は動画内参照
この動画を見る
図1に示す塩化カリウム$KCI$. 硝酸カリウム$KNO_3$, および硫酸マグネシウ$MgSO_4$の水に対する溶解度曲線を用いて、
固体の溶解および析出に関する後の問い(a・b)に答えよ。
b $MgSO_4$の水溶液を冷却して得られる結晶は、$MgSO_4$の水和物である。
水$100g$に、ある量の$MgSO_4$が溶けている水溶液Aを$14℃$に冷却する。
このとき、析出する$MgSO_4$の水和物の質量が$12.3g$であり、その中の水和水の質量が$6.3g$である場合、冷却前の水溶液Aに溶けている$MgSO_4$の質量は何$g$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
①$28$ ②$30$ ③$32$ ④$34$ ⑤$36$ ⑥$42$
※図は動画内参照
共通テスト追試 化学 2023年度 第1問 問3 質量モル濃度

単元:
#化学#化学理論#大学入試過去問(化学)#溶液の性質#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電解質$AB_2$(式量 200)は水中で陽イオン$A^{2+}$と陰イオン$B^{-}$に完全に電離する。
この電解質$AB_2$と非電解質$C$(分子量 150)との混合物$0.50g$が水$100g$に完全に溶けた溶液を考える。
すべての溶質粒子$A^{2+},B^{-},C$を合わせた質量モル濃度が$0.050 mol/kg$であるとき、混合物中の電解質$AB_2$の含有率(質量パーセント)は何$%$か。
最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、水溶液中では$A^{2+},B^{-},C$はそれぞれ単独の溶質粒子として存在するとし、電離以外の化学反応は起こらないものとする。
①$20$ ②$33$ ③$40$ ④$50$ ⑤$67$
この動画を見る
電解質$AB_2$(式量 200)は水中で陽イオン$A^{2+}$と陰イオン$B^{-}$に完全に電離する。
この電解質$AB_2$と非電解質$C$(分子量 150)との混合物$0.50g$が水$100g$に完全に溶けた溶液を考える。
すべての溶質粒子$A^{2+},B^{-},C$を合わせた質量モル濃度が$0.050 mol/kg$であるとき、混合物中の電解質$AB_2$の含有率(質量パーセント)は何$%$か。
最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、水溶液中では$A^{2+},B^{-},C$はそれぞれ単独の溶質粒子として存在するとし、電離以外の化学反応は起こらないものとする。
①$20$ ②$33$ ③$40$ ④$50$ ⑤$67$
共通テスト(旧センター試験)過去問解説 化学 2015年 第4問 問6 エステルの加水分解の計算問題

単元:
#化学#有機#大学入試過去問(化学)#酸素を含む脂肪族化合物#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
原子量$H1C 12 O 16$
示性式$C_mH_{2m+1}COOC_nH_{2n+1}$で表されるエステル $1.0mol$を完全に加水分解し、2種類の有機化合物がそれぞれ$74g$生成した。
このとき$m$および$n$の数の組合せとして最も適当なものを、次の①~⑥のうちから一つ選べ。
※表は動画内参照
この動画を見る
原子量$H1C 12 O 16$
示性式$C_mH_{2m+1}COOC_nH_{2n+1}$で表されるエステル $1.0mol$を完全に加水分解し、2種類の有機化合物がそれぞれ$74g$生成した。
このとき$m$および$n$の数の組合せとして最も適当なものを、次の①~⑥のうちから一つ選べ。
※表は動画内参照
【定期テスト対策】化学基礎 一問一答(13) 物質量の計算Lv.2

単元:
#その他#その他
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
第1問 $H1C12$ アボガドロ定数$6,0 \times 10^{23}/mol$
メタン$CH_4 1.6g$に含まれる水素原子の数を 有効数字2桁の値で求めよ。
第2問 $MgCl_2 = 95$
塩化物イオン$1.0mol$を含む塩化マグネシウムの質量$[g]$を有効数字2桁で求めなさい。
第3問 $H1C 12 N 14 O 16 CI 35.5$
同温・同圧で同質量の気体のうち、最も体積が 大きくなる気体はどれか。
① メタン$CH_4$ ② 窒素$N_2$ ③ 酸素$O_2$
④二酸化炭素$CO_2$ ⑤ 塩素$Cl_2$
第4問 $H1C 12 O 16$ モル体積$22.4L/mol$
$0℃,1.013 \times 10^5Pa$において、体積比$2:1$のメタンと二酸化炭素からなる混合気体$1.0L$の質量$〔g〕$を有効数字2桁で求めよ。
第5問 $H_2SO_4 = 98$
密度$1.8g/mL$の濃硫酸のモル濃度 $[mol/L]$を有効数字2桁で 求めなさい。
第6問 C3H8 = 44 モル体積
$0℃,1.013 \times 10^5Pa$ プロパン$C_3H_8$の密度 $[g/L]$を有効数字2桁で求めなさい。
この動画を見る
第1問 $H1C12$ アボガドロ定数$6,0 \times 10^{23}/mol$
メタン$CH_4 1.6g$に含まれる水素原子の数を 有効数字2桁の値で求めよ。
第2問 $MgCl_2 = 95$
塩化物イオン$1.0mol$を含む塩化マグネシウムの質量$[g]$を有効数字2桁で求めなさい。
第3問 $H1C 12 N 14 O 16 CI 35.5$
同温・同圧で同質量の気体のうち、最も体積が 大きくなる気体はどれか。
① メタン$CH_4$ ② 窒素$N_2$ ③ 酸素$O_2$
④二酸化炭素$CO_2$ ⑤ 塩素$Cl_2$
第4問 $H1C 12 O 16$ モル体積$22.4L/mol$
$0℃,1.013 \times 10^5Pa$において、体積比$2:1$のメタンと二酸化炭素からなる混合気体$1.0L$の質量$〔g〕$を有効数字2桁で求めよ。
第5問 $H_2SO_4 = 98$
密度$1.8g/mL$の濃硫酸のモル濃度 $[mol/L]$を有効数字2桁で 求めなさい。
第6問 C3H8 = 44 モル体積
$0℃,1.013 \times 10^5Pa$ プロパン$C_3H_8$の密度 $[g/L]$を有効数字2桁で求めなさい。
無機化学第5回 ハロゲン化水素の性質 HFとHClを中心におさえよう

有機化学第7回 付加重合 C=Cはプラスチックの原材料

【定期テスト対策】化学基礎 一問一答(12) 物質量の計算の基本Lv.1

単元:
#その他#その他
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
第1問 $1.5 \times 10^{23}$個の電子は何$mol$か。
第2問 $3.6g$の水は何$mol$か。
第3問 モル体積$22.4L/mol$
$0℃,1.013 \times 10^5Pa$の窒素が$0.15mol$ある。
体積は何$L$か。
小数点1位の値まで求めよ。
第4問 $0.20mol$の水酸化が$200mL$の水に溶けている。
モル濃度$[mol/L]$を求めよ。
第5問 原子量$H1C12$
$8.0g$のメタン$CH_4$に含まれるメタン分子は何個か。
第6問原子量$C12016$ モル体積$22.4L/mol$
$11g$のドライアイス$CO_2$がすべて昇華すると、$0℃,1.013 \times 10^5Pa$ において何$L$になるか。
第7問 モル体積$22.4L/mol$
$0℃,1.013 \times 10^5Pa$で$2.8L$のアンモニアを水に溶かし、$100mL$の水溶液ができた。
モル濃度$[mol/L]$を小数第1位までの値で求めよ。
①$n〔mol〕=\displaystyle \frac{x}{6.0 \times 10^{23}/mol}$
②$n〔mol〕=\displaystyle \frac{w〔g〕}{M〔g/mol〕}$
③$n〔mol〕=\displaystyle \frac{V〔L〕}{22.4l/mol}$
④$n〔mol〕=c〔mol/L〕 \times \displaystyle \frac{v}{1000}〔L〕$
この動画を見る
第1問 $1.5 \times 10^{23}$個の電子は何$mol$か。
第2問 $3.6g$の水は何$mol$か。
第3問 モル体積$22.4L/mol$
$0℃,1.013 \times 10^5Pa$の窒素が$0.15mol$ある。
体積は何$L$か。
小数点1位の値まで求めよ。
第4問 $0.20mol$の水酸化が$200mL$の水に溶けている。
モル濃度$[mol/L]$を求めよ。
第5問 原子量$H1C12$
$8.0g$のメタン$CH_4$に含まれるメタン分子は何個か。
第6問原子量$C12016$ モル体積$22.4L/mol$
$11g$のドライアイス$CO_2$がすべて昇華すると、$0℃,1.013 \times 10^5Pa$ において何$L$になるか。
第7問 モル体積$22.4L/mol$
$0℃,1.013 \times 10^5Pa$で$2.8L$のアンモニアを水に溶かし、$100mL$の水溶液ができた。
モル濃度$[mol/L]$を小数第1位までの値で求めよ。
①$n〔mol〕=\displaystyle \frac{x}{6.0 \times 10^{23}/mol}$
②$n〔mol〕=\displaystyle \frac{w〔g〕}{M〔g/mol〕}$
③$n〔mol〕=\displaystyle \frac{V〔L〕}{22.4l/mol}$
④$n〔mol〕=c〔mol/L〕 \times \displaystyle \frac{v}{1000}〔L〕$
【定期テスト対策】化学基礎 一問一答(11)(原子量~物質量)

単元:
#化学#化学基礎2ー物質の変化#物質量と濃度#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
第1問 現在の相対量の基準を述べなさい。
第2問 空欄を埋めよ。
原子量とは、各元素の( )の相対質量と存在比から求めた平均値で表されている。
第3問 原子量・分子量・式量の数値は相対的な質量を表すが、この数値にgをつけたものは何を意味するか。
第4問 アボガドロの法則とは何か。
第5問 アボガドロ定数を$6.0 \times 10^{23}/mol$として、$n〔mol〕=$の形で粒子数と物質量の関係を示しなさい。
第6問 ある物質$w〔g〕$がある。その物質のモル質量を$M〔g/mol〕$として$n〔mol〕=$の形で質量と物質量の関係を示しなさい。
第7問 $0℃,1.013 \times 10^5Pa$の気体が$V〔L〕$ある。
$n〔mol〕=$の形で体積と物質量の関係を示しなさい。
第8問 モル濃度$c〔mol/L〕$の水溶液が$v〔mol/L〕$ある。
$n〔mol〕=$の形でモル濃度と物質量の関係を示しなさい。
第9問 ①密度とは何か説明しなさい。 また、②科学計算において密度が与えられたときやるべきことを答えなさい。
この動画を見る
第1問 現在の相対量の基準を述べなさい。
第2問 空欄を埋めよ。
原子量とは、各元素の( )の相対質量と存在比から求めた平均値で表されている。
第3問 原子量・分子量・式量の数値は相対的な質量を表すが、この数値にgをつけたものは何を意味するか。
第4問 アボガドロの法則とは何か。
第5問 アボガドロ定数を$6.0 \times 10^{23}/mol$として、$n〔mol〕=$の形で粒子数と物質量の関係を示しなさい。
第6問 ある物質$w〔g〕$がある。その物質のモル質量を$M〔g/mol〕$として$n〔mol〕=$の形で質量と物質量の関係を示しなさい。
第7問 $0℃,1.013 \times 10^5Pa$の気体が$V〔L〕$ある。
$n〔mol〕=$の形で体積と物質量の関係を示しなさい。
第8問 モル濃度$c〔mol/L〕$の水溶液が$v〔mol/L〕$ある。
$n〔mol〕=$の形でモル濃度と物質量の関係を示しなさい。
第9問 ①密度とは何か説明しなさい。 また、②科学計算において密度が与えられたときやるべきことを答えなさい。
共通テスト(旧センター試験)過去問解説 化学 2015年 第4問 問5 芳香族化合物の分離
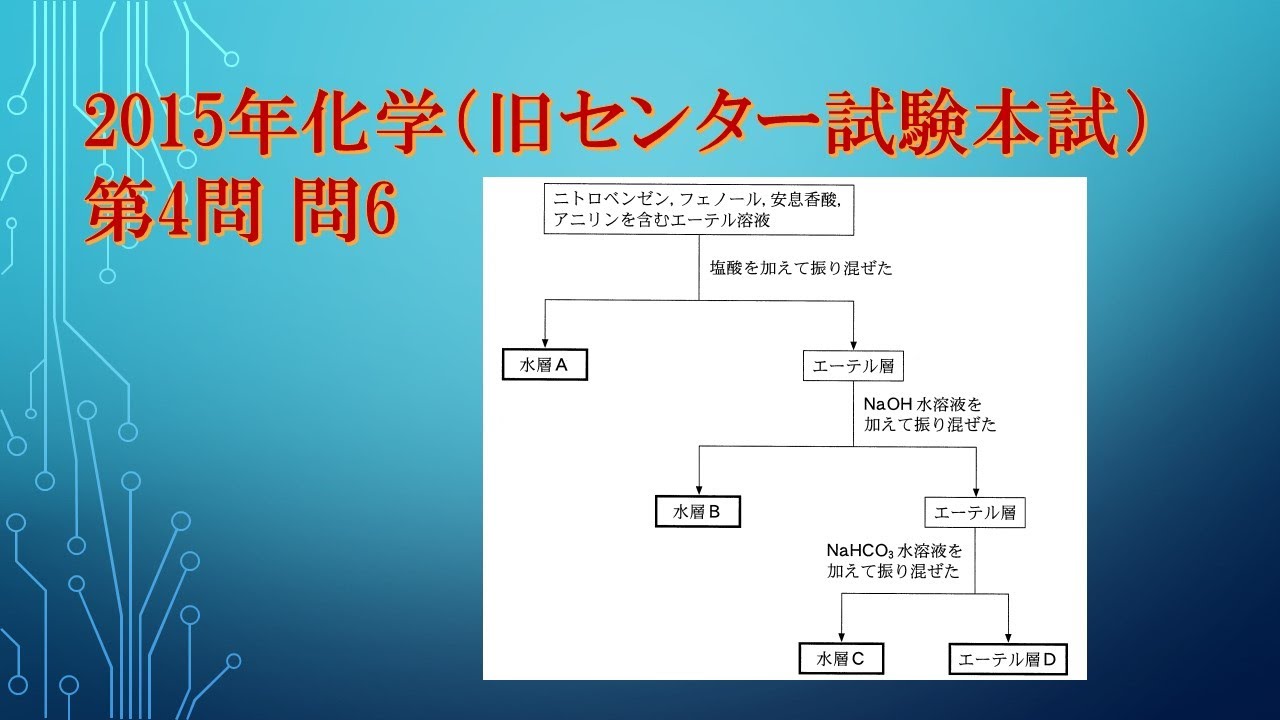
単元:
#化学#有機#大学入試過去問(化学)#芳香族化合物#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ニトロベンゼン、フェノール、安息香酸、アニリンを含むジエチルエーテル (エーテル)溶液がある。
これら4種類の芳香族化合物をそれぞれ分離するため、
図1の手順で実験を行い、水層A~Cとエーテル層Dを得た。
しかし、 図1の手順は不適切であったため、A~Dのうち、
ある層には2種類の芳香族化合物が含まれてしまった。
その層と2種類の芳香族化合物の組合せとして最も適当なものを、下の①~③のうちから一つ選べ。
ただし、層に含まれる芳香族化合物は、塩として存在することもある。
※図・表は動画内参照
この動画を見る
ニトロベンゼン、フェノール、安息香酸、アニリンを含むジエチルエーテル (エーテル)溶液がある。
これら4種類の芳香族化合物をそれぞれ分離するため、
図1の手順で実験を行い、水層A~Cとエーテル層Dを得た。
しかし、 図1の手順は不適切であったため、A~Dのうち、
ある層には2種類の芳香族化合物が含まれてしまった。
その層と2種類の芳香族化合物の組合せとして最も適当なものを、下の①~③のうちから一つ選べ。
ただし、層に含まれる芳香族化合物は、塩として存在することもある。
※図・表は動画内参照
化学基礎の教科書を解説する動画 第50回 塩の化学反応



