 化学結合
化学結合
 化学結合
化学結合
【高校化学】次の文中の( )に適切な語句または数値を入れ、下の問いに答えよ。分子の構造を推定するとき、電子対は互いに反発し合うため、その反発が最小になる分子構造をとると

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
理数個別チャンネル
問題文全文(内容文):
次の文中の( )に適切な語句または数値を入れ、下の問いに答えよ。
分子の構造を推定するとき、電子対は互いに反発し合うため、その反発が最小になる分子構造をとると仮定する。
アンモニア分子は、窒素原子のまわりに3組の共有電子対と1組の非共有電子対が存在するので、図のように、4組の電子対が窒素原子を中心に四面体形の頂点方向に位置する。そのため、分子構造は三角錐形となる。
水の場合、酸素原子のまわりに(ア)組の共有電子対と(イ)組の非共有電子対が存在するので、分子構造は(ウ)形となる。
また、二重結合を含む分子の構造を推定するときには、これらの結合は1組の電子対とみなしてよく、たとえば二酸化炭素では、炭素原子のまわりに非共有電子対がなく、二重結合が(エ)組存在することから、分子構造は(オ)形となることが予想できる。
(問) オゾン分子O₃の電子式が右のように表されるとすると、分子はどのような構造をしていると推定できるか。簡潔に説明せよ。
この動画を見る
次の文中の( )に適切な語句または数値を入れ、下の問いに答えよ。
分子の構造を推定するとき、電子対は互いに反発し合うため、その反発が最小になる分子構造をとると仮定する。
アンモニア分子は、窒素原子のまわりに3組の共有電子対と1組の非共有電子対が存在するので、図のように、4組の電子対が窒素原子を中心に四面体形の頂点方向に位置する。そのため、分子構造は三角錐形となる。
水の場合、酸素原子のまわりに(ア)組の共有電子対と(イ)組の非共有電子対が存在するので、分子構造は(ウ)形となる。
また、二重結合を含む分子の構造を推定するときには、これらの結合は1組の電子対とみなしてよく、たとえば二酸化炭素では、炭素原子のまわりに非共有電子対がなく、二重結合が(エ)組存在することから、分子構造は(オ)形となることが予想できる。
(問) オゾン分子O₃の電子式が右のように表されるとすると、分子はどのような構造をしていると推定できるか。簡潔に説明せよ。
【高校化学】化学結合の種類は、結合する2つの元素間の電気陰性度の差によっておおよそ次のように区別できる。NaClは図1の三角形の頂点側NOは三角形の右下側に位置しそれぞれイオン

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
理数個別チャンネル
問題文全文(内容文):
化学結合の種類は、結合する2つの元素間の電気陰性度の差によっておおよそ次のように区別できる。
NaClは図1の三角形の頂点側、NOは三角形の右下側に位置し、それぞれイオン結合、共有結合を形成する。
このように、イオン結合と共有結合との領域の境界を点線で示す。この三角形を右から左へたどると、物質中の化学結合に関与する電子に対して、その物質中の原子が束縛する強度が徐々に弱まり、その電子は(ア)電子ともよばれるようになる。
つまり、図1の三角形の左下側に位置する物質では、金属結合の特徴をもつ。
また、結合を共有結合と金属結合との境界に位置する物質は両方の特徴をあわせもつことも多い。
たとえば、金属的半導体アルミニウムやGeの電気陰性度差は約1.0±1.99で、境界付近に位置し、伝導率や絶縁体の中間の性質を示す(イ)となる。
(1) (ア)、(イ)に当てはまる語句を記せ。
(2) (イ)に属すると考えられる物質を(a)〜(e)から1つ選べ。
(a) Mg₃N₂ (b) SnBr₄ (c) GaAs (d) CS₂ (e) SiC
この動画を見る
化学結合の種類は、結合する2つの元素間の電気陰性度の差によっておおよそ次のように区別できる。
NaClは図1の三角形の頂点側、NOは三角形の右下側に位置し、それぞれイオン結合、共有結合を形成する。
このように、イオン結合と共有結合との領域の境界を点線で示す。この三角形を右から左へたどると、物質中の化学結合に関与する電子に対して、その物質中の原子が束縛する強度が徐々に弱まり、その電子は(ア)電子ともよばれるようになる。
つまり、図1の三角形の左下側に位置する物質では、金属結合の特徴をもつ。
また、結合を共有結合と金属結合との境界に位置する物質は両方の特徴をあわせもつことも多い。
たとえば、金属的半導体アルミニウムやGeの電気陰性度差は約1.0±1.99で、境界付近に位置し、伝導率や絶縁体の中間の性質を示す(イ)となる。
(1) (ア)、(イ)に当てはまる語句を記せ。
(2) (イ)に属すると考えられる物質を(a)〜(e)から1つ選べ。
(a) Mg₃N₂ (b) SnBr₄ (c) GaAs (d) CS₂ (e) SiC
【高校化学】図は、4種類の元素a〜dについて原子の電子配置を模式的に示したものである。ここで●は原子核、○は電子、点の円は電子殻を表す。次の各問いに答えよ(1) 4種類の元素a〜d

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
理数個別チャンネル
問題文全文(内容文):
図は、4種類の元素a〜dについて、原子の電子配置を模式的に示したものである。ここで、●は原子核、○は電子、点の円は電子殻を表す。次の各問いに答えよ。
(1) 4種類の元素a〜dの名称をそれぞれ記せ。
(2) 元素aは、化学結合を行う時に電子を引き寄せる力が最も強い。この強さを表す尺度を何というか。
(3) 元素aと周期表で同周期に属する元素で、第1イオン化エネルギーが最小であるものはどれか。それぞれ元素記号で答えよ。
(4) 元素aと元素cが1個ずつ結びついて化合物をつくるとき、
この化合物について、名称、化学式、分子の形(次の①〜⑥のうちから1つ)および分子の極性の有無を答えよ。
① 直線形 ② 折れ線形 ③ 正方形 ④ 三角錐形 ⑤ 四面体形 ⑥ 正八面体形
この動画を見る
図は、4種類の元素a〜dについて、原子の電子配置を模式的に示したものである。ここで、●は原子核、○は電子、点の円は電子殻を表す。次の各問いに答えよ。
(1) 4種類の元素a〜dの名称をそれぞれ記せ。
(2) 元素aは、化学結合を行う時に電子を引き寄せる力が最も強い。この強さを表す尺度を何というか。
(3) 元素aと周期表で同周期に属する元素で、第1イオン化エネルギーが最小であるものはどれか。それぞれ元素記号で答えよ。
(4) 元素aと元素cが1個ずつ結びついて化合物をつくるとき、
この化合物について、名称、化学式、分子の形(次の①〜⑥のうちから1つ)および分子の極性の有無を答えよ。
① 直線形 ② 折れ線形 ③ 正方形 ④ 三角錐形 ⑤ 四面体形 ⑥ 正八面体形
【高校化学】結晶と化学結合次の(ア)~ (カ)の結晶について 下の各問いに答えよ(ア)二酸化炭素(イ)塩化アンモニウム(ウ)ヨウ化カリウム(エ)ダイヤモンド(オ)アルミニウム(カ)二酸化ケイ素

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
次の(ア)~ (カ)の結晶について 下の各問いに答えよ。
(ア)二酸化炭素(イ)塩化アンモニウム(ウ)ヨウ化カリウム(エ)ダイヤモンド(オ)アルミニウム(カ)二酸化ケイ素
(1) (ア)~(カ) の結晶は、次の (a) ~ (d) のどれにあてはまるか。
(a) 分子結晶 (b) イオン結晶 (c) 金属結晶 (d) 共有結合の結晶
(2) (ア)~(カ) の結晶中に働いている力や結合の種類を、次の(a)~(e) からすべて選べ。
(a) イオン結合 (b) 分子間力 (b) 分子間力 (c) 共有結合 (d) 金属結合 (e) 配位結合
この動画を見る
次の(ア)~ (カ)の結晶について 下の各問いに答えよ。
(ア)二酸化炭素(イ)塩化アンモニウム(ウ)ヨウ化カリウム(エ)ダイヤモンド(オ)アルミニウム(カ)二酸化ケイ素
(1) (ア)~(カ) の結晶は、次の (a) ~ (d) のどれにあてはまるか。
(a) 分子結晶 (b) イオン結晶 (c) 金属結晶 (d) 共有結合の結晶
(2) (ア)~(カ) の結晶中に働いている力や結合の種類を、次の(a)~(e) からすべて選べ。
(a) イオン結合 (b) 分子間力 (b) 分子間力 (c) 共有結合 (d) 金属結合 (e) 配位結合
【高校化学】分子間力次の文中の空欄に適切な語句を入れ下の各問いに答えよ。分子からできている物質では状態変化をおこす温度は分子間力に大きく依存している。分子間力のうち、すべて

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
次の文中の空欄に適切な語句を入れ、下の各問いに答えよ。
分子からできている物質では、状態変化をおこす温度は分子間力に大きく依存している。分子間力のうち、すべての分子に働く弱い引力を(A)とよぶ。14〜17族の水素化合物の分子量(分子の質量の相対値)と沸点の関係を図に示す。14族の水素化合物のように、構造のよく似ている分子では、(A)と沸点の間に一定の傾向がある。
(1) 図中の(ア)〜(エ)の化合物は何か。それぞれ化学式で記せ。
(2) 下線部について、一定の傾向とはどのようなものか。30字程度で記せ。
(3) SiH₄とHClの分子量はほぼ同じであるが、沸点はHClの方が高い。その理由を、極性分子、無極性分子などの用語を用いて簡潔に記せ。
(4) HF、NH₃の沸点が同族の水素化合物に比べて異常に高い理由を20字程度で記せ。
この動画を見る
次の文中の空欄に適切な語句を入れ、下の各問いに答えよ。
分子からできている物質では、状態変化をおこす温度は分子間力に大きく依存している。分子間力のうち、すべての分子に働く弱い引力を(A)とよぶ。14〜17族の水素化合物の分子量(分子の質量の相対値)と沸点の関係を図に示す。14族の水素化合物のように、構造のよく似ている分子では、(A)と沸点の間に一定の傾向がある。
(1) 図中の(ア)〜(エ)の化合物は何か。それぞれ化学式で記せ。
(2) 下線部について、一定の傾向とはどのようなものか。30字程度で記せ。
(3) SiH₄とHClの分子量はほぼ同じであるが、沸点はHClの方が高い。その理由を、極性分子、無極性分子などの用語を用いて簡潔に記せ。
(4) HF、NH₃の沸点が同族の水素化合物に比べて異常に高い理由を20字程度で記せ。
【高校化学】分子の構造と極性次の文中の(ア)~(オ)に当てはまる最も適切な語句を、下の解答群の中から1つずつ選べ。水素原子Hと酸素原子Oの間に(ア)の差があるため、水分子

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
次の文中の(ア)~(オ)に当てはまる最も適切な語句を、下の解答群の中から1つずつ選べ。
水素原子Hと酸素原子Oの間に(ア)の差があるため、水分子中の共有電子対はOの方にいくらか引き寄せられて電荷のかたよりを生じる。水分子は形状が(イ)形の構造であり、2つのO-H結合の極性の向きは打ち消し合うことなく、分子全体として極性を示す。一方、炭素原子Cを含む三原子分子である二酸化炭素はC=O結合に電荷のかたよりはあるが、(ウ)形の構造であるために分子全体として極性をもたない。四原子分子のアンモニアは(エ)形の構造であるために極性分子になるが、硫黄原子Sを含む気体の三酸化硫黄SO₃は(オ)形の構造であるため、無極性分子になる。
(ア)の解答群
①原子半径②原子量③原子番号④電気陰性度
(イ)~(オ)の解答群
①直線②平面正三角③平面正四角④正四面体⑤三角錐⑥折れ線
この動画を見る
次の文中の(ア)~(オ)に当てはまる最も適切な語句を、下の解答群の中から1つずつ選べ。
水素原子Hと酸素原子Oの間に(ア)の差があるため、水分子中の共有電子対はOの方にいくらか引き寄せられて電荷のかたよりを生じる。水分子は形状が(イ)形の構造であり、2つのO-H結合の極性の向きは打ち消し合うことなく、分子全体として極性を示す。一方、炭素原子Cを含む三原子分子である二酸化炭素はC=O結合に電荷のかたよりはあるが、(ウ)形の構造であるために分子全体として極性をもたない。四原子分子のアンモニアは(エ)形の構造であるために極性分子になるが、硫黄原子Sを含む気体の三酸化硫黄SO₃は(オ)形の構造であるため、無極性分子になる。
(ア)の解答群
①原子半径②原子量③原子番号④電気陰性度
(イ)~(オ)の解答群
①直線②平面正三角③平面正四角④正四面体⑤三角錐⑥折れ線
【高校化学】化学結合次の文中の空欄に当てはまる語句を記入し下の各問いに答えよ。水分子中では、水素原子と酸素原子がそれぞれ不対電子を出し合って(ア)電子対をつくり、(ア)結

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
次の文中の空欄に当てはまる語句を記入し、下の各問いに答えよ。
水分子中では、水素原子と酸素原子がそれぞれ不対電子を出し合って(ア)電子対をつくり、(ア)結合している。水分子中の酸素原子は(イ)電子対をもち、これを水素イオンに供与して(ア)結合を形成し、オキソニウムイオンとなる。このようにしてできる結合を、特に(ウ)結合という。一般に、異なる原子間で(ア)結合が形成されると、電子対は一方の原子の方により引きつけられる。この電子対を引きつける強さを示す尺度を原子の(エ)といい、結合している原子間に電荷の偏りがあることを結合に極性があるという。分子中の結合に極性があっても、分子全体では極性が打ち消し合って、極性をもたない分子もある。
(1) 下線部(a)について、オキソニウムイオンの電子式を記せ。
(2) 下線部(b)に対応する分子の例を2つ選べ。また、それぞれの構造式を記せ。
①塩化水素②メタン③アンモニア④二酸化炭素⑤メタノール⑥ジクロロメタン
この動画を見る
次の文中の空欄に当てはまる語句を記入し、下の各問いに答えよ。
水分子中では、水素原子と酸素原子がそれぞれ不対電子を出し合って(ア)電子対をつくり、(ア)結合している。水分子中の酸素原子は(イ)電子対をもち、これを水素イオンに供与して(ア)結合を形成し、オキソニウムイオンとなる。このようにしてできる結合を、特に(ウ)結合という。一般に、異なる原子間で(ア)結合が形成されると、電子対は一方の原子の方により引きつけられる。この電子対を引きつける強さを示す尺度を原子の(エ)といい、結合している原子間に電荷の偏りがあることを結合に極性があるという。分子中の結合に極性があっても、分子全体では極性が打ち消し合って、極性をもたない分子もある。
(1) 下線部(a)について、オキソニウムイオンの電子式を記せ。
(2) 下線部(b)に対応する分子の例を2つ選べ。また、それぞれの構造式を記せ。
①塩化水素②メタン③アンモニア④二酸化炭素⑤メタノール⑥ジクロロメタン
【高校化学】イオンと分子① ~ ④はイオンまたは分子を表し ており,Hは水素, a,b,d,eは水素以外の原子 を表す。 ① は正四面体構造をもつ1価の陽イオンで, aH3 と H+ との反応で生成

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
① ~ ④はイオンまたは分子を表し ており,$\rm {H}$は水素, $\rm a$,$\rm b$,$\rm d$,$\rm e$は水素以外の原子 を表す。 ① は正四面体構造をもつ1価の陽イオンで, $ \rm {aH_3}$ と $\rm {H^+}$ との反応で生成する。 $\rm a$は最外殻のL殻に 5個の電子をもつ。 $\rm b$の2価の陰イオン $\rm {b^{2-}}$ は,アル ゴンと同じ電子配置をとる。 $\rm d$ の単体には, ダイヤモ ンドがある。 ④は平面構造をしており, $\rm e$は$\rm b$と同族 であり,元素の周期表で1つ上の周期の原子である。 (1) $\rm a$,$\rm b$,$\rm d$,$\rm e$の元素名を記せ。 (2) 二重結合および三重結合をもつものはどれか。 それぞれ番号で示せ。 (3) 下線部のように, 非共有電子対を与えて形成される結合を何というか。
この動画を見る
① ~ ④はイオンまたは分子を表し ており,$\rm {H}$は水素, $\rm a$,$\rm b$,$\rm d$,$\rm e$は水素以外の原子 を表す。 ① は正四面体構造をもつ1価の陽イオンで, $ \rm {aH_3}$ と $\rm {H^+}$ との反応で生成する。 $\rm a$は最外殻のL殻に 5個の電子をもつ。 $\rm b$の2価の陰イオン $\rm {b^{2-}}$ は,アル ゴンと同じ電子配置をとる。 $\rm d$ の単体には, ダイヤモ ンドがある。 ④は平面構造をしており, $\rm e$は$\rm b$と同族 であり,元素の周期表で1つ上の周期の原子である。 (1) $\rm a$,$\rm b$,$\rm d$,$\rm e$の元素名を記せ。 (2) 二重結合および三重結合をもつものはどれか。 それぞれ番号で示せ。 (3) 下線部のように, 非共有電子対を与えて形成される結合を何というか。
モル濃度の求め方を1分で解説!

【旧センター試験化学】2019追試 第1問 問4 結晶と非晶質

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問4 いろいろな物質の結晶・非晶質に関する記述として誤りを含むものを、次の
①~⑤のうちから一つ選べ。
① 共有結合でできている結晶には、分子結晶に比べて融点が高いものが多い。
② 金属結晶では、面心立方格子をとる原子の配位数は体心立方格子をとる原子の配位数より多い。
③ イオン結晶では、単位格子に含まれる陽イオンと陰イオンの数の比は、組成式で示されるイオンの数の比と等しい。
④ すべての単体の結晶は共有結合でできている。
⑤ 非品質は一定の融点を示さない。
この動画を見る
問4 いろいろな物質の結晶・非晶質に関する記述として誤りを含むものを、次の
①~⑤のうちから一つ選べ。
① 共有結合でできている結晶には、分子結晶に比べて融点が高いものが多い。
② 金属結晶では、面心立方格子をとる原子の配位数は体心立方格子をとる原子の配位数より多い。
③ イオン結晶では、単位格子に含まれる陽イオンと陰イオンの数の比は、組成式で示されるイオンの数の比と等しい。
④ すべての単体の結晶は共有結合でできている。
⑤ 非品質は一定の融点を示さない。
【最も質問の多い問題!!】ヘスの法則と反応エンタルピーの演習〔現役講師解説、高校化学、化学基礎、新課程版〕

単元:
#化学#化学基礎1ー物質の構成#化学基礎2ー物質の変化#化学結合#化学変化と化学反応式#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
ヘスの法則と反応エンタルピーに関して解説していきます。
この動画を見る
ヘスの法則と反応エンタルピーに関して解説していきます。
太陽に地球を入れたら何個入るか?

2024追試第3問 問3c 配位したアンモニアの数の計算
単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
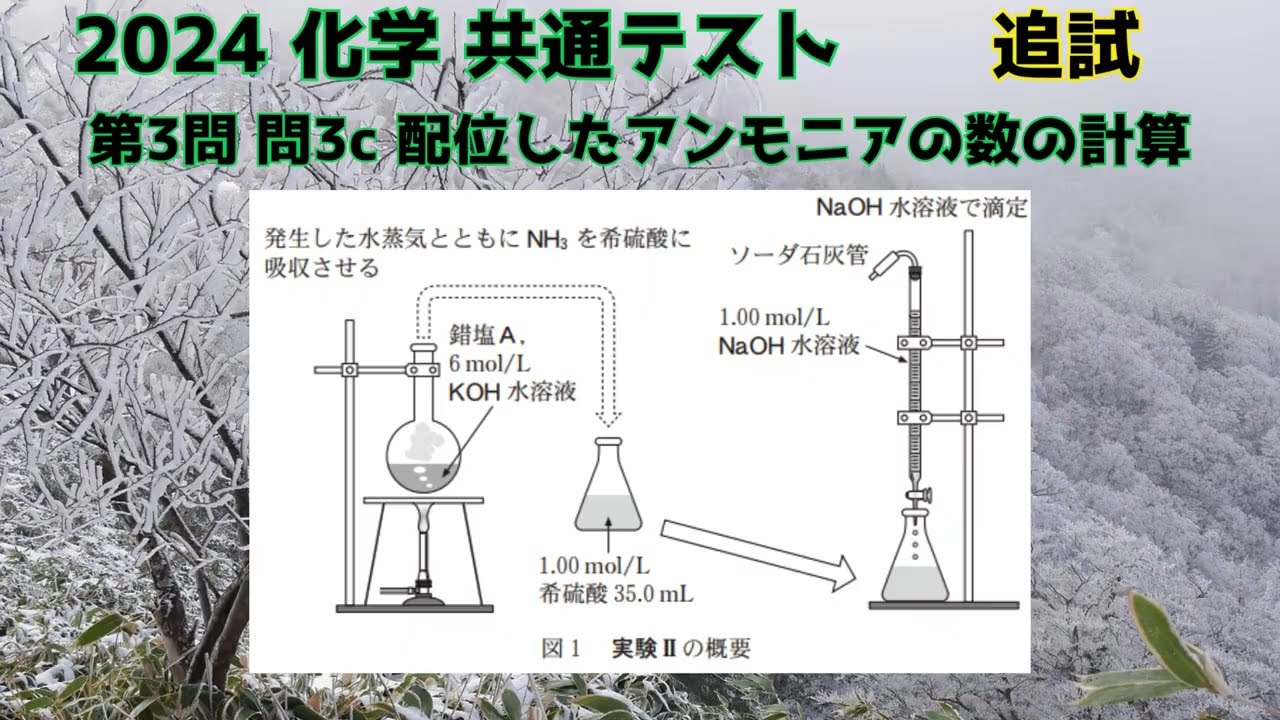
結果に基づき、$\ce{Co^{3+}}$を$0.0100\,\rm{mol}$ 含む$A$をはかり取り、丸底フラスコに入れ、図1に示すように、$A$中から$\ce{NH3}$を完全に発生させるために 十分な体積の$6\,\rm{mol/L}$ 水酸化カリウム$\ce{KOH}$水溶液を加えて煮沸した。
このとき、発生した水蒸気とともに$\ce{NH3}$を$1.00\,\rm{mol/L}$の希硫酸$35.0\,\rm{mL}$にすべ て吸収させた。$\ce{NH3}$を吸収した希硫酸に適切な指示薬$B$を加え、$1.00\,\rm{mol/L}$ の水酸化ナトリウム $\ce{NaOH}$水溶液を使って滴定した。
結果Ⅱ 指示薬$B$の変色には$20.00\,\rm{mL}$の$\ce{NaOH}$水溶液が必要であった。
結果Ⅱから、一つの$\ce{Co^{3+}}$に配位結合している$\ce{NH3}$の数はいくつになるか。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、Aに含 まれている$\ce{NH3}$はすべて$\ce{Co^{3+}}$に配位結合しており、$\ce{NH3}$は$A$が分解された後、すべて希硫酸に吸収されたものとする。
※図は動画内参照
この動画を見る
結果に基づき、$\ce{Co^{3+}}$を$0.0100\,\rm{mol}$ 含む$A$をはかり取り、丸底フラスコに入れ、図1に示すように、$A$中から$\ce{NH3}$を完全に発生させるために 十分な体積の$6\,\rm{mol/L}$ 水酸化カリウム$\ce{KOH}$水溶液を加えて煮沸した。
このとき、発生した水蒸気とともに$\ce{NH3}$を$1.00\,\rm{mol/L}$の希硫酸$35.0\,\rm{mL}$にすべ て吸収させた。$\ce{NH3}$を吸収した希硫酸に適切な指示薬$B$を加え、$1.00\,\rm{mol/L}$ の水酸化ナトリウム $\ce{NaOH}$水溶液を使って滴定した。
結果Ⅱ 指示薬$B$の変色には$20.00\,\rm{mL}$の$\ce{NaOH}$水溶液が必要であった。
結果Ⅱから、一つの$\ce{Co^{3+}}$に配位結合している$\ce{NH3}$の数はいくつになるか。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、Aに含 まれている$\ce{NH3}$はすべて$\ce{Co^{3+}}$に配位結合しており、$\ce{NH3}$は$A$が分解された後、すべて希硫酸に吸収されたものとする。
※図は動画内参照
小さいのになんで落ちへんの?

1分で解いてほしい化学計算問題 (50) 単位格子の種類が変わると密度はどうなるか?

単元:
#化学#化学基礎1ー物質の構成#大学入試過去問(化学)#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[2022年 麻布大学]
鉄$Fe$は$900℃$では体心立方格子の結晶(体積:$ 2.4×10^{-23}cm^3$)をつくるが$910℃$では面心立方格子の結晶(体積:$4.3×10^{-23}cm^3$)に変化する。
鉄の結晶格子が体心立方格子から面心立方格子に変化したとき鉄の密度は何倍になるか。
最も近い値を選べ。
①$0.82$
②$0.93$
③$1.14$
④$1.3$
⑤$2.2$
⑥$2.6$
この動画を見る
[2022年 麻布大学]
鉄$Fe$は$900℃$では体心立方格子の結晶(体積:$ 2.4×10^{-23}cm^3$)をつくるが$910℃$では面心立方格子の結晶(体積:$4.3×10^{-23}cm^3$)に変化する。
鉄の結晶格子が体心立方格子から面心立方格子に変化したとき鉄の密度は何倍になるか。
最も近い値を選べ。
①$0.82$
②$0.93$
③$1.14$
④$1.3$
⑤$2.2$
⑥$2.6$
グラフ問題 一部の水素化合物の沸点が異常に高い理由とは?

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
グラフは、$14~17$族の水素化合物の分子量と沸点を表している。
1:$15~17$族の水素化合物のうち、分子量が最も小さい物質の沸点は異常に高いが、それはなぜか。
2:一般に分子量が大きくなると沸点が上昇するが、
それはなぜか。
※グラフは動画内参照
この動画を見る
グラフは、$14~17$族の水素化合物の分子量と沸点を表している。
1:$15~17$族の水素化合物のうち、分子量が最も小さい物質の沸点は異常に高いが、それはなぜか。
2:一般に分子量が大きくなると沸点が上昇するが、
それはなぜか。
※グラフは動画内参照
グラフ問題 イオン化エネルギー・価電子数のグラフを選べ!

単元:
#化学#化学基礎1ー物質の構成#大学入試過去問(化学)#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
横軸に原子番号を表したグラフである。
縦軸がイオン化エネルギーを表しているもの、縦軸に価電子を表しているものはどれか、それぞれ選びなさい。
(2021杏林大学)
※グラフは動画内参照
この動画を見る
横軸に原子番号を表したグラフである。
縦軸がイオン化エネルギーを表しているもの、縦軸に価電子を表しているものはどれか、それぞれ選びなさい。
(2021杏林大学)
※グラフは動画内参照
理論化学第8回 共有結合結晶 ダイヤモンド結晶の充填率を求めよう!

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
理論化学第8回 共有結合結晶 ダイヤモンド結晶の充填率を求めよう!
$C$(ダイヤモンド), $Si,SiO_2$等融点はきわめて高い、硬い
※図は動画内参照
この動画を見る
理論化学第8回 共有結合結晶 ダイヤモンド結晶の充填率を求めよう!
$C$(ダイヤモンド), $Si,SiO_2$等融点はきわめて高い、硬い
※図は動画内参照
理論化学第7回 イオン結晶の計算問題(2)限界半径比について

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
イオン結晶の計算問題を解こう。
限界半経比:$\displaystyle \frac{y+}{r-}$
陰イオンと陽イオンは接している。
※図は動画内参照
この動画を見る
イオン結晶の計算問題を解こう。
限界半経比:$\displaystyle \frac{y+}{r-}$
陰イオンと陽イオンは接している。
※図は動画内参照
理論化学第6回 イオン結晶の計算問題(1)密度…個数に注意!

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
理論化学第6回 イオン結晶の計算問題(1)密度…個数に注意!
密度の計算をせよ。
$Na=23,Cℓ=35.5$
$V=1.8 \times 10^{-22}cm^3$
$Na=6.0 \times 10^{23}mol$
※図は動画内参照
この動画を見る
理論化学第6回 イオン結晶の計算問題(1)密度…個数に注意!
密度の計算をせよ。
$Na=23,Cℓ=35.5$
$V=1.8 \times 10^{-22}cm^3$
$Na=6.0 \times 10^{23}mol$
※図は動画内参照
2023麻布大学 水素吸蔵合金の密度変化に関する問題!

単元:
#化学#化学基礎1ー物質の構成#大学入試過去問(化学)#化学結合#理科(高校生)#麻布大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
原子量 $H = 1 Pd = 106$ アボガドロ定数$6.0×10^{23}/mol$
金属パラジウム $Pd$の結晶は面心立方格子からなり、
それを 水素気流中で加熱したのち冷却すると、
結晶格子の隙間に 水素原子($H$原子)が取り込まれる。
これを水素の吸蔵という。
ただし、パラジウム結晶の単位格子の$1$辺は$4.0×10{-8}cm$ とし、水素原子は次の図の●のすべての位置に入るものとする。
水素を含まない金属パラジウム結晶の密度$(g/cm^3)$はどれか。
最も近い値を選べ。
①$10$
②$11$
③$12$
④$13$
⑤$14$
⑥$15$
⑦$16$
⑧$17$
パラジウムが水素を吸蔵するとき、結晶の体積が$20%$増加する。
水素吸蔵後の結晶の密度は水素吸蔵前の密度の何倍か。
①$0.52$
②$0.58$
③$0.68$
④$0.79$
⑤$0.84$
※図は動画内参照
この動画を見る
原子量 $H = 1 Pd = 106$ アボガドロ定数$6.0×10^{23}/mol$
金属パラジウム $Pd$の結晶は面心立方格子からなり、
それを 水素気流中で加熱したのち冷却すると、
結晶格子の隙間に 水素原子($H$原子)が取り込まれる。
これを水素の吸蔵という。
ただし、パラジウム結晶の単位格子の$1$辺は$4.0×10{-8}cm$ とし、水素原子は次の図の●のすべての位置に入るものとする。
水素を含まない金属パラジウム結晶の密度$(g/cm^3)$はどれか。
最も近い値を選べ。
①$10$
②$11$
③$12$
④$13$
⑤$14$
⑥$15$
⑦$16$
⑧$17$
パラジウムが水素を吸蔵するとき、結晶の体積が$20%$増加する。
水素吸蔵後の結晶の密度は水素吸蔵前の密度の何倍か。
①$0.52$
②$0.58$
③$0.68$
④$0.79$
⑤$0.84$
※図は動画内参照
理論化学第5回 イオン結晶 NaCl型・CsCl型と面心立方格子・体心立方格子との共通点・相違点を考えよう!

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
理論化学第5回 イオン結晶 NaCl型・CsCl型と面心立方格子・体心立方格子との共通点・相違点を考えよう!
・$NaCℓ$型・・・面心立方格子に似ている。
・$CsCℓ$型・・・体心立方格子に似ている。
※図は動画内参照
この動画を見る
理論化学第5回 イオン結晶 NaCl型・CsCl型と面心立方格子・体心立方格子との共通点・相違点を考えよう!
・$NaCℓ$型・・・面心立方格子に似ている。
・$CsCℓ$型・・・体心立方格子に似ている。
※図は動画内参照
1分で解いてほしい化学計算問題 (45) 単位格子と原子半径

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
〔2023年 共立女子大学 (改)〕
原子半径が$1.2 \times 10^{-8}$である鉄が体心立方格子の結晶構造をとるとき、
単位格子の一辺の長さは何$cm$か。
有効数字2桁で答えよ。
ただし、結晶を構成する原子が歪みのない球であり、
結晶内では最も近いところに存在する原子は互いに接触しているものとする。
$\sqrt{ 2 }=1.41,\sqrt{ 3 }=1.73$
この動画を見る
〔2023年 共立女子大学 (改)〕
原子半径が$1.2 \times 10^{-8}$である鉄が体心立方格子の結晶構造をとるとき、
単位格子の一辺の長さは何$cm$か。
有効数字2桁で答えよ。
ただし、結晶を構成する原子が歪みのない球であり、
結晶内では最も近いところに存在する原子は互いに接触しているものとする。
$\sqrt{ 2 }=1.41,\sqrt{ 3 }=1.73$
理論化学第4回 体心立方格子 Naの密度や充填率を求めてみよう!

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
理論化学第4回 体心立方格子 Naの密度や充填率を求めてみよう!
(例)$Na$原子(M:23)
・原子半径
・密度[$g/cm^3$]
・充鎮率
※図は動画内参照
この動画を見る
理論化学第4回 体心立方格子 Naの密度や充填率を求めてみよう!
(例)$Na$原子(M:23)
・原子半径
・密度[$g/cm^3$]
・充鎮率
※図は動画内参照
理論化学第3回 面心立方格子 定番の単位格子一辺の長さと原子半径の関係,金属の密度問題

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
原子半径$r$と単位格子$a$の関係
原子は正味何個?
また、$Cu$の密度を求めよ。
($Cu=63.5$)
$N_A=6.0 \times 10^{23}/mol$
$a=3.6 \times 10^{-8}cm$
※図は動画内参照
この動画を見る
原子半径$r$と単位格子$a$の関係
原子は正味何個?
また、$Cu$の密度を求めよ。
($Cu=63.5$)
$N_A=6.0 \times 10^{23}/mol$
$a=3.6 \times 10^{-8}cm$
※図は動画内参照
理論化学第2回 金属結晶の構造 最密構造はどれか,配位数はいくらかを理解しよう!

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
理論化学第2回 金属結晶の構造 最密構造はどれか,配位数はいくらかを理解しよう!
穴埋めせよ。
面心立方格子
六方最密構造
→細密構造
配位数____
体心立方格子
→配位数__
この動画を見る
理論化学第2回 金属結晶の構造 最密構造はどれか,配位数はいくらかを理解しよう!
穴埋めせよ。
面心立方格子
六方最密構造
→細密構造
配位数____
体心立方格子
→配位数__
1分で解いてほしい化学計算問題 (35) Nで表す問題

単元:
#化学#化学基礎1ー物質の構成#化学基礎2ー物質の変化#大学入試過去問(化学)#化学結合#物質量と濃度#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[2023年 東京薬科大学(改)]
$440g$の二酸化炭素について、アボガドロ数$ (6.02×10^{23})$ を$N$としたとき、以下のそれぞれの量を$N$を用いて表しなさい。
(原子量$C=12 O = 16$)
①電子の数
②原子核の数
③酸素原子の数
④共有結合に使われている電子の数
⑤非共有電子対の数
この動画を見る
[2023年 東京薬科大学(改)]
$440g$の二酸化炭素について、アボガドロ数$ (6.02×10^{23})$ を$N$としたとき、以下のそれぞれの量を$N$を用いて表しなさい。
(原子量$C=12 O = 16$)
①電子の数
②原子核の数
③酸素原子の数
④共有結合に使われている電子の数
⑤非共有電子対の数
1分で解いてほしい化学計算問題 (21) 金属結晶の密度

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[2023年 愛知医科大学]
アルミニウムの単体は面心立方格子の結晶構造をもつ金属であり、単位格子の一辺の長さは$4.0×10^{-8}cm$であるとする。
アルミニウムの密度は 何$g/cm^3$か。
有効数字2桁で答えよ。
アボガドロ定数 $6.0×10^{23}/mol AI$の原子量 $27.0$
この動画を見る
[2023年 愛知医科大学]
アルミニウムの単体は面心立方格子の結晶構造をもつ金属であり、単位格子の一辺の長さは$4.0×10^{-8}cm$であるとする。
アルミニウムの密度は 何$g/cm^3$か。
有効数字2桁で答えよ。
アボガドロ定数 $6.0×10^{23}/mol AI$の原子量 $27.0$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第1問 問2 ナトリウムの単位格子
単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)#化学#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
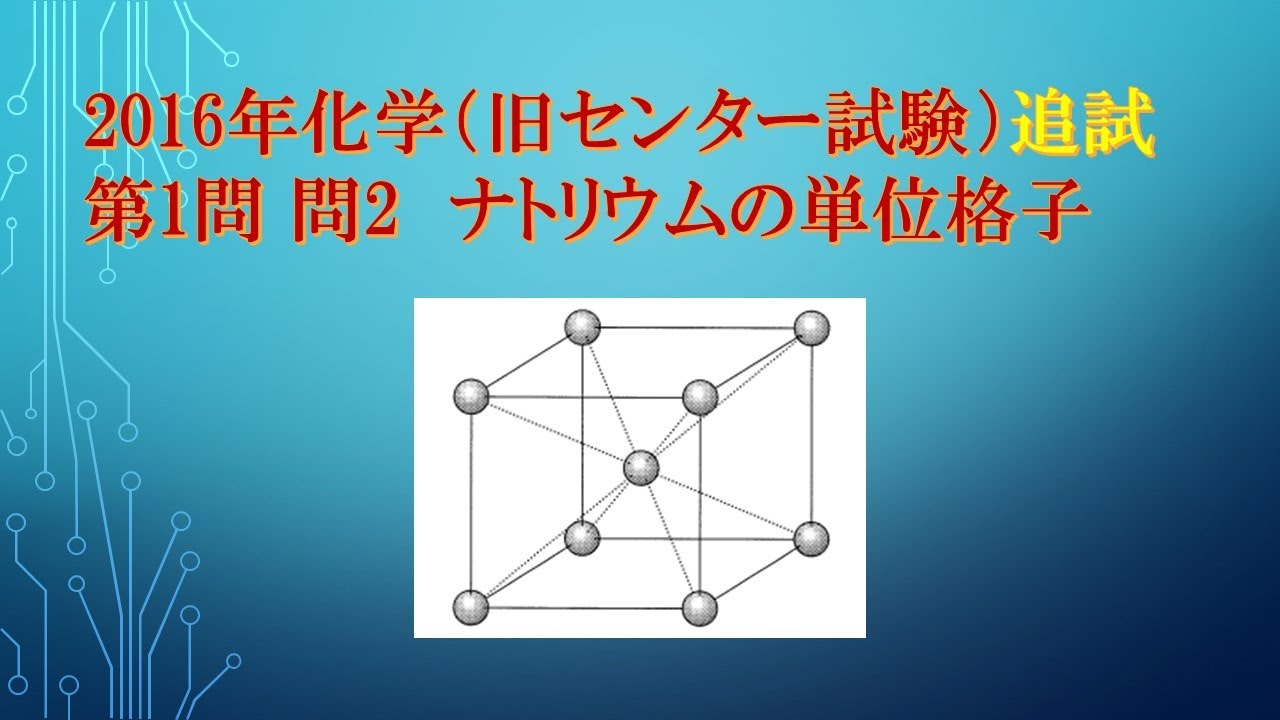
金属結晶では、金属原子が規則正しく配列している。
金属ナトリウムの単位格子は、図1の立方体で表される。
金属ナトリウムの密度を$d[g/cm^3]$.
ナトリウムのモル質量を$W(g/mol]$、
アボガドロ定数を$N_{A} 〔/mol〕$としたとき、
単位格子の体積を表す式として正しいものを、
下の①~⑥のうちから一つ選べ。
①$\displaystyle \frac{WN_{A}}{d}$
②$\displaystyle \frac{2WN_{A}}{d}$
③$\displaystyle \frac{5WN_{A}}{d}$
④$\displaystyle \frac{W}{dN_{A}}$
⑤$\displaystyle \frac{2W}{dN_{A}}$
⑥$\displaystyle \frac{5W}{dN_{A}}$
この動画を見る
金属結晶では、金属原子が規則正しく配列している。
金属ナトリウムの単位格子は、図1の立方体で表される。
金属ナトリウムの密度を$d[g/cm^3]$.
ナトリウムのモル質量を$W(g/mol]$、
アボガドロ定数を$N_{A} 〔/mol〕$としたとき、
単位格子の体積を表す式として正しいものを、
下の①~⑥のうちから一つ選べ。
①$\displaystyle \frac{WN_{A}}{d}$
②$\displaystyle \frac{2WN_{A}}{d}$
③$\displaystyle \frac{5WN_{A}}{d}$
④$\displaystyle \frac{W}{dN_{A}}$
⑤$\displaystyle \frac{2W}{dN_{A}}$
⑥$\displaystyle \frac{5W}{dN_{A}}$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第6問 問1 化学結合の種類

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)#化学#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
共有結合を含まない物質を、次の①~⑥のうちから一つ選べ。
①水素 ②オゾン ③カリウム
④単斜硫黄 ⑤ベンゼン ⑥塩化水素
この動画を見る
共有結合を含まない物質を、次の①~⑥のうちから一つ選べ。
①水素 ②オゾン ③カリウム
④単斜硫黄 ⑤ベンゼン ⑥塩化水素
