 電池と電気分解
電池と電気分解
 電池と電気分解
電池と電気分解
【旧センター試験化学】2019追試 第2問 問3 電気分解の量的関係

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ある電解質Aの水溶液を,白金電極を用いて電気分解したところ,陽極と陰極から気体が生じ,その物質量の比は1:2であった。電解質Aおよび陽極で発生した気体の組合せとして最も適当なものを,次の①~④のうちから一つ選べ。
① 電解質A: H$_2$SO$_4$、陽極で発生した気体: 酸素
② 電解質A: AgNO$_3$、陽極で発生した気体: 酸素
③ 電解質A: NaCl、陽極で発生した気体: 塩素
④ 電解質A: CuCl$_2$、陽極で発生した気体: 塩素
この動画を見る
ある電解質Aの水溶液を,白金電極を用いて電気分解したところ,陽極と陰極から気体が生じ,その物質量の比は1:2であった。電解質Aおよび陽極で発生した気体の組合せとして最も適当なものを,次の①~④のうちから一つ選べ。
① 電解質A: H$_2$SO$_4$、陽極で発生した気体: 酸素
② 電解質A: AgNO$_3$、陽極で発生した気体: 酸素
③ 電解質A: NaCl、陽極で発生した気体: 塩素
④ 電解質A: CuCl$_2$、陽極で発生した気体: 塩素
【旧センター試験化学】2019追試 第2問 問6 電離定数とpHの関係

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電離平衡の状態にある弱酸HAの水溶液では,HAの電離度は1より十分小さく,また,水素イオンのもるのうど[H⁺]とHAから電離して生じたA⁻のモル濃度[
[A⁻]は等しいと考えることができる。HAの電離定数K aを
K a=([H⁺][A⁻])/[HA]=10^(-x)mol/L
と表すとき,0.10mol/LのHA水溶液について,xとpHの関係を示すグラフとして最も適当なものを,次の①~⑥
の内から一つ選べ。
この動画を見る
電離平衡の状態にある弱酸HAの水溶液では,HAの電離度は1より十分小さく,また,水素イオンのもるのうど[H⁺]とHAから電離して生じたA⁻のモル濃度[
[A⁻]は等しいと考えることができる。HAの電離定数K aを
K a=([H⁺][A⁻])/[HA]=10^(-x)mol/L
と表すとき,0.10mol/LのHA水溶液について,xとpHの関係を示すグラフとして最も適当なものを,次の①~⑥
の内から一つ選べ。
理論化学基礎演習53 イオン交換膜法

【旧センター試験化学】2020追試 第2問 問3 水溶液の電気分解

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
Cl:35.5 Cu:64
炭素棒を電極として用い,塩化銅($Ⅱ$)水溶液の電気分解を行った。$0.50 A$の一定電流を$965$ 秒間流したとき,陰極で生じた物質の質量〔$g$〕として最も適当なものを,次の①~⑤のうちから一つ選べ。ただし,電気分解を行うために十分な量の塩化銅($Ⅱ$)が溶けていたものとし,ファラデー定数は$9.65×10^4 C/mol$とする。また,流れた電流はすべて塩化銅($Ⅱ$)の電気分解に使われたものとする。
この動画を見る
Cl:35.5 Cu:64
炭素棒を電極として用い,塩化銅($Ⅱ$)水溶液の電気分解を行った。$0.50 A$の一定電流を$965$ 秒間流したとき,陰極で生じた物質の質量〔$g$〕として最も適当なものを,次の①~⑤のうちから一つ選べ。ただし,電気分解を行うために十分な量の塩化銅($Ⅱ$)が溶けていたものとし,ファラデー定数は$9.65×10^4 C/mol$とする。また,流れた電流はすべて塩化銅($Ⅱ$)の電気分解に使われたものとする。
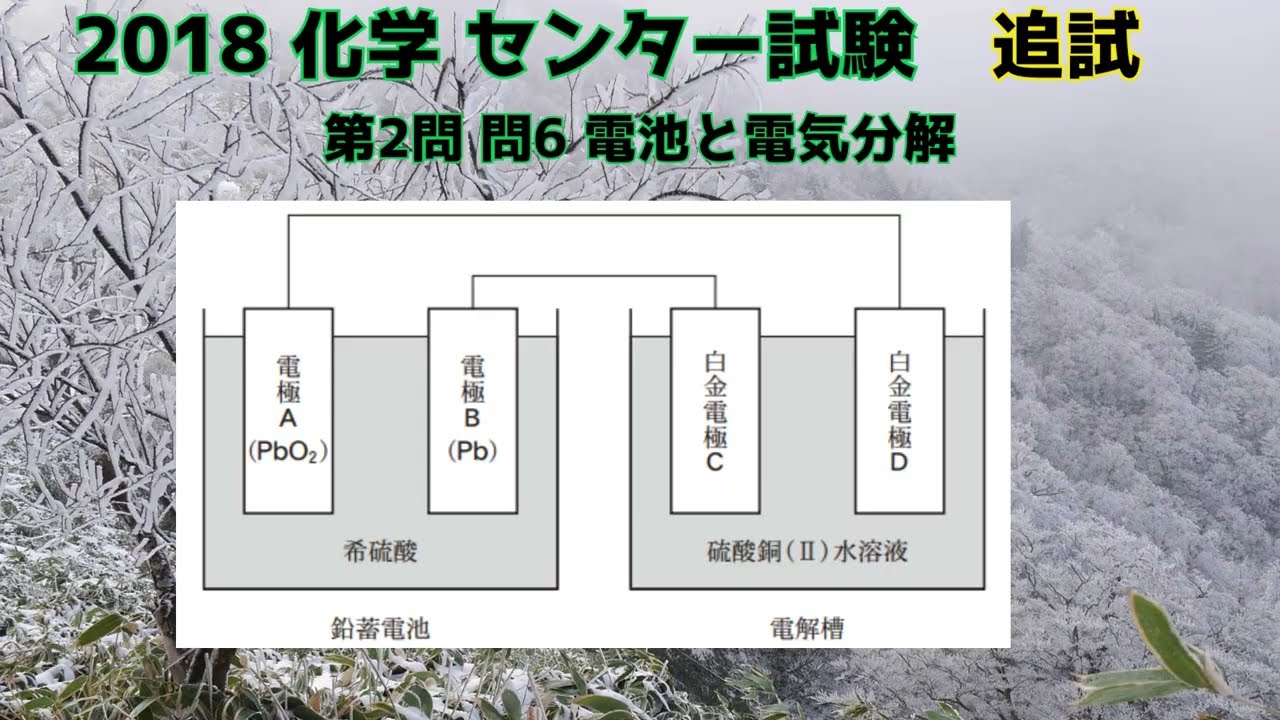
【旧センター試験化学】2018追試 第2問 問6 電池と電気分解
2024追試第2問 問4c カールフィッシャー法による水の定量

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
下線部Cについて、液体試料中に含まれる微量な水$\ce{H2O}$の物質量を求める方法としてカールフィッシャー法がある。
この方法では、メタノールにヨウ化カリウム$\ce{KI}$などを溶解した溶液に、微量の$\ce{H2O}$を含む液体試料を加え 電気分解を行う。
このとき電気分解によって$\ce{I^-}$から生成した$\ce{I2}$が、同じ物 質量の$\ce{H2O}$とともに反応により消費されることを利用している。
$\ce{H2O}$がす べて消費され、余剰の$\ce{I2}$が検出されるまでの電気分解に要した電気量から$\ce{H2O}$の物質量を求めることができる。
微量の$\ce{H2O}$を含んだある液体試料について、電流$5.00×10\,\rm{A}$で電気分解したところ、余剰の$\ce{I2}$が検出されるまでに$193$秒要した。
この試料に 含まれていた$\ce{H2O}$の物質量は何$\rm{mol}$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、流れた電流はすべて$\ce{I2}$の生成に用いられたも のとし、その他の物質の電極での反応は考えないものとする。
①$5.00 \times 10^{-5}$
②$1.00 \times 10^{-4}$
③$5.00 \times 10^{-4}$
④$1.00 \times 10^{-3}$
⑤$5.00 \times 10^{-3}$
⑥$1.00 \times 10^{-2}$
この動画を見る
下線部Cについて、液体試料中に含まれる微量な水$\ce{H2O}$の物質量を求める方法としてカールフィッシャー法がある。
この方法では、メタノールにヨウ化カリウム$\ce{KI}$などを溶解した溶液に、微量の$\ce{H2O}$を含む液体試料を加え 電気分解を行う。
このとき電気分解によって$\ce{I^-}$から生成した$\ce{I2}$が、同じ物 質量の$\ce{H2O}$とともに反応により消費されることを利用している。
$\ce{H2O}$がす べて消費され、余剰の$\ce{I2}$が検出されるまでの電気分解に要した電気量から$\ce{H2O}$の物質量を求めることができる。
微量の$\ce{H2O}$を含んだある液体試料について、電流$5.00×10\,\rm{A}$で電気分解したところ、余剰の$\ce{I2}$が検出されるまでに$193$秒要した。
この試料に 含まれていた$\ce{H2O}$の物質量は何$\rm{mol}$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、流れた電流はすべて$\ce{I2}$の生成に用いられたも のとし、その他の物質の電極での反応は考えないものとする。
①$5.00 \times 10^{-5}$
②$1.00 \times 10^{-4}$
③$5.00 \times 10^{-4}$
④$1.00 \times 10^{-3}$
⑤$5.00 \times 10^{-3}$
⑥$1.00 \times 10^{-2}$
2024追試第2問 問4b 電気量と析出する金属の質量

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
下線部について、硫酸銅(Ⅱ) $CuSO_4$
水溶液の電気分解によって析出する銅$Cu$の質量と流れた電気量の関係を図1に示す。
$Q_0(C)$は、$Cu$が$16g$析出するときに流れた電気量である。
酸化アルミニウム$Al_2O_3$の溶融塩電 解によってアルミニウム $Al$の単体を得るとき、
流れた電気量と析出する$Al$ の質量の関係を示したグラフとして最も適当なものを、後の①~④のうちから一つ選べ。
ただし、流れた電子はすべて$Cu$または$Al$の析出に使用され たものとする。
※表は動画内参照
この動画を見る
下線部について、硫酸銅(Ⅱ) $CuSO_4$
水溶液の電気分解によって析出する銅$Cu$の質量と流れた電気量の関係を図1に示す。
$Q_0(C)$は、$Cu$が$16g$析出するときに流れた電気量である。
酸化アルミニウム$Al_2O_3$の溶融塩電 解によってアルミニウム $Al$の単体を得るとき、
流れた電気量と析出する$Al$ の質量の関係を示したグラフとして最も適当なものを、後の①~④のうちから一つ選べ。
ただし、流れた電子はすべて$Cu$または$Al$の析出に使用され たものとする。
※表は動画内参照
2024追試第2問 問4a 銅の電解精錬の知識問題

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
下線部について、銅の精錬に関する次の文章中の空欄㋐~㋓に当てはまる語句の組合せとして最も適当なものを、後の①~④のうちから一つ選べ。
銅の精錬では、純度の低い粗銅板を㋐に、純度99.99%以上の純銅板を㋑として0.3V程度の低電圧の条件で電解精練を行う。不純物として亜鉛$Zn$と銀$Ag$が含まれた組銅板を㋐とした場合、不純物の㋒は粗銅板の下に堆積する。
一方、不純物の㋓はイオンとなって溶け出し、
溶液中に残る。
※表は動画内参照
この動画を見る
下線部について、銅の精錬に関する次の文章中の空欄㋐~㋓に当てはまる語句の組合せとして最も適当なものを、後の①~④のうちから一つ選べ。
銅の精錬では、純度の低い粗銅板を㋐に、純度99.99%以上の純銅板を㋑として0.3V程度の低電圧の条件で電解精練を行う。不純物として亜鉛$Zn$と銀$Ag$が含まれた組銅板を㋐とした場合、不純物の㋒は粗銅板の下に堆積する。
一方、不純物の㋓はイオンとなって溶け出し、
溶液中に残る。
※表は動画内参照
理論化学基礎演習8 鉛蓄電池放電後の希硫酸の濃度変化

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
質量パーセント濃度$28$%,密度$1.2g/cm^3$の希硫酸$0.50L$を電解液とする鉛蓄電池を、
塩化銅(II)水溶液に$2$枚の白金電極を浸した電解槽につなぎ、電気分解を行った。
その結果、
電解槽の陰極上に銅が$6.4g$析出した。
鉛蓄電池の電解液に用いられている希硫酸の質量パーセント濃度は何%になったか。
有効数字2桁で求めなさい。
(原子量$H1O 16 S 32 Cu 64$)
この動画を見る
質量パーセント濃度$28$%,密度$1.2g/cm^3$の希硫酸$0.50L$を電解液とする鉛蓄電池を、
塩化銅(II)水溶液に$2$枚の白金電極を浸した電解槽につなぎ、電気分解を行った。
その結果、
電解槽の陰極上に銅が$6.4g$析出した。
鉛蓄電池の電解液に用いられている希硫酸の質量パーセント濃度は何%になったか。
有効数字2桁で求めなさい。
(原子量$H1O 16 S 32 Cu 64$)
グラフ問題21 電気分解における電気量と発生した気体の量の関係

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図のような装置で$2.0mol/L$の水酸化ナトリウムで10分間電気分解したとき、時間と電極Aと電極Bで発生する気体の物質量の関係として正しいものを選べ。
※図・グラフは動画内参照
この動画を見る
図のような装置で$2.0mol/L$の水酸化ナトリウムで10分間電気分解したとき、時間と電極Aと電極Bで発生する気体の物質量の関係として正しいものを選べ。
※図・グラフは動画内参照
共通テスト(旧センター試験)過去問解説 化学 2017年追試 第2問 問6 電池の知識問題

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電池に関する記述として正しいものを、次の①~⑥のうちから一つ選べ。
① ダニエル電池は、希硫酸に亜鉛板と銅板を浸したものである。
② 一次電池は、外部から電流を流して、起電力を回復させることができる。
③ リチウム電池の起電力は、マンガン乾電池の起電力より小さい。
④ マンガン乾電池では、正極に酸化マンガン(IV)が、負極に炭素が用いられる。
⑤ 電解液としてリン酸水溶液を用いた燃料電池では、正極で水が生成する。
⑥ 太陽電池は、熱エネルギーを電気エネルギーに変換して、起電力を生じる。
この動画を見る
電池に関する記述として正しいものを、次の①~⑥のうちから一つ選べ。
① ダニエル電池は、希硫酸に亜鉛板と銅板を浸したものである。
② 一次電池は、外部から電流を流して、起電力を回復させることができる。
③ リチウム電池の起電力は、マンガン乾電池の起電力より小さい。
④ マンガン乾電池では、正極に酸化マンガン(IV)が、負極に炭素が用いられる。
⑤ 電解液としてリン酸水溶液を用いた燃料電池では、正極で水が生成する。
⑥ 太陽電池は、熱エネルギーを電気エネルギーに変換して、起電力を生じる。
共通テスト(旧センター試験)過去問解説 化学 2017年追試 第2問 問5 電気分解と固体の析出量
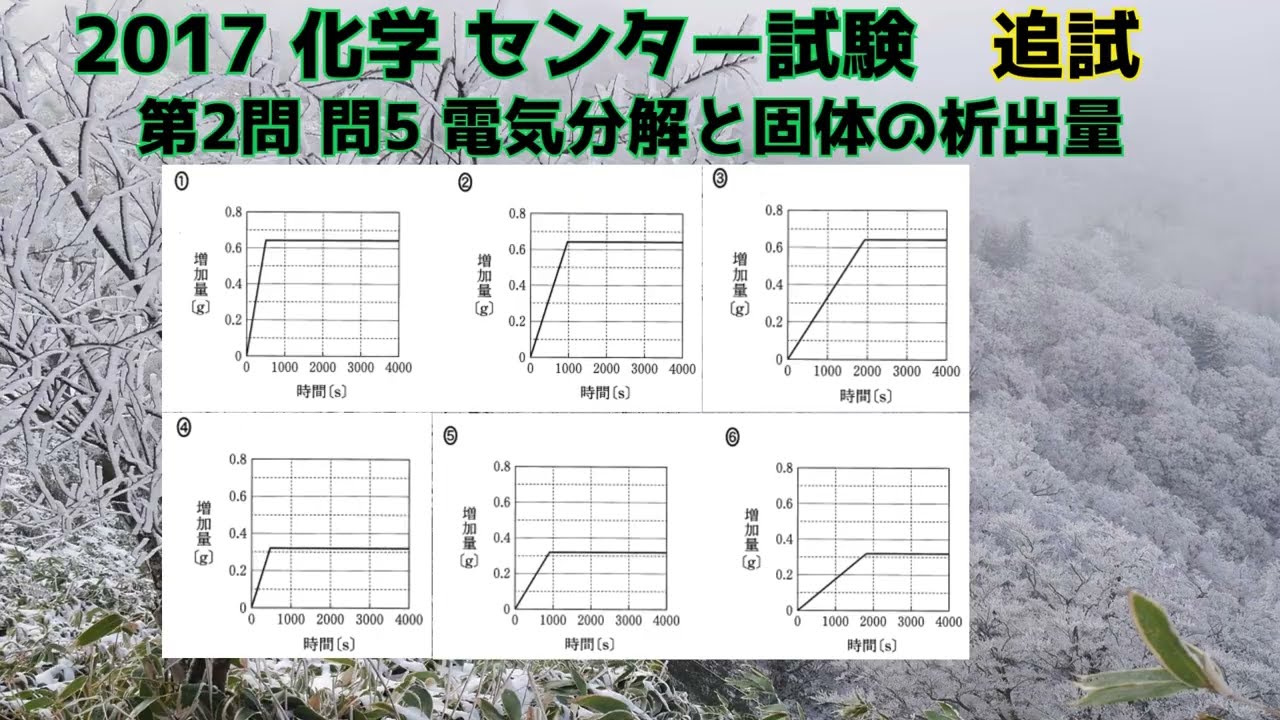
単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
銅$0.64g$と亜鉛$0.32g$を溶かした硫酸水溶液を$1A$の電流で電気分解を行ったとき、
電気分解を行った時間と陰極の質量の増加量との関係を表すグラフとして適当なものを選べ。
陰極では質量増加している間は流れた電流は金属の析出のみに使われているものとする。
※グラフは動画内参照
この動画を見る
銅$0.64g$と亜鉛$0.32g$を溶かした硫酸水溶液を$1A$の電流で電気分解を行ったとき、
電気分解を行った時間と陰極の質量の増加量との関係を表すグラフとして適当なものを選べ。
陰極では質量増加している間は流れた電流は金属の析出のみに使われているものとする。
※グラフは動画内参照
1分で解いてほしい化学計算問題 (43) 電気分解(2)

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
〔2023年 東京工業大学〕
電解槽に$0.100mol/L$の塩化ナトリウム水溶液を$500mL$入れ、炭素電極を用いて電気分解を行った。
一定電流を$5.00 \times 10^{3}$秒間流すと、$0℃、1.013 \times 10^{5}Pa$で$0.224L$の気体が発生した。
電気分解を行ったときの電流は、$0.$__$A$である。
小数第3位を四捨五入して求めなさい。
発生した気体は理想気体としてふるまい、水に溶解せず、互いに反応しないものとする。
(気体のモル体積:$22.4L/mol$,ファラデー定数$9.65 \times 10^4C/mol$)
この動画を見る
〔2023年 東京工業大学〕
電解槽に$0.100mol/L$の塩化ナトリウム水溶液を$500mL$入れ、炭素電極を用いて電気分解を行った。
一定電流を$5.00 \times 10^{3}$秒間流すと、$0℃、1.013 \times 10^{5}Pa$で$0.224L$の気体が発生した。
電気分解を行ったときの電流は、$0.$__$A$である。
小数第3位を四捨五入して求めなさい。
発生した気体は理想気体としてふるまい、水に溶解せず、互いに反応しないものとする。
(気体のモル体積:$22.4L/mol$,ファラデー定数$9.65 \times 10^4C/mol$)
【石川県立大学】令和5年度 後期日程 鉛蓄電池

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
原子量 $H=1.00, O=16.0, S=32.0, Cu=64.0.$
ファラデー定数$ 9.65×10^4C/mol$
代表的な二次電池である鉛蓄電池は、
放電と充電の反応を1つの式で表すと次のようになる。
$Pb + PbO_2 + 2H_2SO_4→2PbSO_4 + 2H_2O$
放電時には式の反応が右方向に進み、
両電極ともに水に溶けにくい白色の硫酸鉛(Ⅱ)
$PbSO_4$で覆われてくる。
(問題) 正極および負極における放電時の反応を、
電子$e^-$を含むイオン反応式でそれぞれ示せ。
(問題) 鉛蓄電池において、電流$5.00A$で2時間40分50秒
放電を行ったとき、流れた電子の物質量を答えよ。
(問題) 前問の放電前の電解質水溶液が質量パーセント濃度
$30.0%$,密度$1.25g/cm^3$の希硫酸
$H_2SO_4 1.00L$であった場合、
放電後の電解質水溶液に含まれる硫酸の質量を答えよ。
この動画を見る
原子量 $H=1.00, O=16.0, S=32.0, Cu=64.0.$
ファラデー定数$ 9.65×10^4C/mol$
代表的な二次電池である鉛蓄電池は、
放電と充電の反応を1つの式で表すと次のようになる。
$Pb + PbO_2 + 2H_2SO_4→2PbSO_4 + 2H_2O$
放電時には式の反応が右方向に進み、
両電極ともに水に溶けにくい白色の硫酸鉛(Ⅱ)
$PbSO_4$で覆われてくる。
(問題) 正極および負極における放電時の反応を、
電子$e^-$を含むイオン反応式でそれぞれ示せ。
(問題) 鉛蓄電池において、電流$5.00A$で2時間40分50秒
放電を行ったとき、流れた電子の物質量を答えよ。
(問題) 前問の放電前の電解質水溶液が質量パーセント濃度
$30.0%$,密度$1.25g/cm^3$の希硫酸
$H_2SO_4 1.00L$であった場合、
放電後の電解質水溶液に含まれる硫酸の質量を答えよ。
2024年度 共通テスト解説 化学 第3問 問4c NiCl₂の電気分解によるNiの析出量

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
c 式(1)で $NiCl_2$と$CuCl$が得られた水溶液から$CuCl$を除いた後、その水溶液を電気分解すると、単体の$Ni$が得られる。
このとき陰極では、式(3)と(4)に示すように$Ni$の析出と気体の水素$H_2$の発生が同時に起こる。
陽極では、式(5)に示すように気体の$CI_2$が発生する。
$NIS + 2 CuCl_2→ NICI_2 + 2CuCl + S$ (1)(再掲)
陰極 $Ni^{2+}+ 2e^{-} → Ni$ (3)
$2H{+} +2e{-}→ H_2$ (4)
陽極 $2 CI^{-}→ Cl_2+2e^{-}$ (5)
電気分解により$H_2$と$Cl_2$が安定に発生しはじめてから、
さらに時間$t(s)$だけ電気分解を続ける。
この間に発生する$H_2$と$Cl_2$の体積が、温度$T(K)$、
圧力$P(Pa)$のもとでそれぞれ $V_{w2}(I_n)$ と $V_{CI3}(L)$
のとき、陰極に析出する$Ni$の質量$w(g)$を表す式として
最も適当なものを、後の①~⑥のうち から一つ選べ。
ただし、$Ni$ のモル質量は$M(g/mol)$、気体定数は$R(Pa・L/(K・mol))$とする。
また、流れた電流はすべて式(3)~(5)の反応に使われるものとし、$H_2$と$Ch_2$の水溶液への溶解は無視できるものとする。
①$\displaystyle \frac{MP(V_{CI2}+V_{H2})}{RT}$
②$\displaystyle \frac{MP(V_{CI2}-V_{W2})}{RT}$
③$\displaystyle \frac{MP(V_{W2}-V_{CI2})}{RT}$
④$\displaystyle \frac{2MP(V_{CI2}+V_{W2})}{RT}$
⑤$\displaystyle \frac{2MP(V_{CI2}-V_{W2})}{RT}$
⑥$\displaystyle \frac{2MP(V_{H2}-V_{CI2})}{RT}$
この動画を見る
c 式(1)で $NiCl_2$と$CuCl$が得られた水溶液から$CuCl$を除いた後、その水溶液を電気分解すると、単体の$Ni$が得られる。
このとき陰極では、式(3)と(4)に示すように$Ni$の析出と気体の水素$H_2$の発生が同時に起こる。
陽極では、式(5)に示すように気体の$CI_2$が発生する。
$NIS + 2 CuCl_2→ NICI_2 + 2CuCl + S$ (1)(再掲)
陰極 $Ni^{2+}+ 2e^{-} → Ni$ (3)
$2H{+} +2e{-}→ H_2$ (4)
陽極 $2 CI^{-}→ Cl_2+2e^{-}$ (5)
電気分解により$H_2$と$Cl_2$が安定に発生しはじめてから、
さらに時間$t(s)$だけ電気分解を続ける。
この間に発生する$H_2$と$Cl_2$の体積が、温度$T(K)$、
圧力$P(Pa)$のもとでそれぞれ $V_{w2}(I_n)$ と $V_{CI3}(L)$
のとき、陰極に析出する$Ni$の質量$w(g)$を表す式として
最も適当なものを、後の①~⑥のうち から一つ選べ。
ただし、$Ni$ のモル質量は$M(g/mol)$、気体定数は$R(Pa・L/(K・mol))$とする。
また、流れた電流はすべて式(3)~(5)の反応に使われるものとし、$H_2$と$Ch_2$の水溶液への溶解は無視できるものとする。
①$\displaystyle \frac{MP(V_{CI2}+V_{H2})}{RT}$
②$\displaystyle \frac{MP(V_{CI2}-V_{W2})}{RT}$
③$\displaystyle \frac{MP(V_{W2}-V_{CI2})}{RT}$
④$\displaystyle \frac{2MP(V_{CI2}+V_{W2})}{RT}$
⑤$\displaystyle \frac{2MP(V_{CI2}-V_{W2})}{RT}$
⑥$\displaystyle \frac{2MP(V_{H2}-V_{CI2})}{RT}$
2024年度 共通テスト解説 化学 第2問 問3 電池の反応物の質量と電気量の関係

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
アルカリマンガン乾電池、空気亜鉛電池(空気電池)、リチウム電池の、放電における電池全体での反応はそれぞれ式(2)~(4)で表されるものとする。
それぞ れの電池の放電反応において、反応物の総量が$1kg$ 消費されるときに流れる電気量$Q$を比較する。
これらの電池を、$Q$の大きい順に並べたものはどれか。
最も適当なものを、後の①~⑥のうちから一つ選べ。
ただし、反応に関与 する物質の式量(原子量・分子量を含む)は表1に示す値とする。
アルカリマンガン乾電池
$2 MnO_2 + Zn + 2H_2O →2MnO (OH) + Zn(OH)_2$ (2)
空気亜鉛電池
$O_2 + 2Zn →2 ZnO$ (3)
リチウム電池
$Li+ MnO_2 →LiMnO_z$ (4)
※表は動画内参照
この動画を見る
アルカリマンガン乾電池、空気亜鉛電池(空気電池)、リチウム電池の、放電における電池全体での反応はそれぞれ式(2)~(4)で表されるものとする。
それぞ れの電池の放電反応において、反応物の総量が$1kg$ 消費されるときに流れる電気量$Q$を比較する。
これらの電池を、$Q$の大きい順に並べたものはどれか。
最も適当なものを、後の①~⑥のうちから一つ選べ。
ただし、反応に関与 する物質の式量(原子量・分子量を含む)は表1に示す値とする。
アルカリマンガン乾電池
$2 MnO_2 + Zn + 2H_2O →2MnO (OH) + Zn(OH)_2$ (2)
空気亜鉛電池
$O_2 + 2Zn →2 ZnO$ (3)
リチウム電池
$Li+ MnO_2 →LiMnO_z$ (4)
※表は動画内参照
これホンマなん?
1分で解いてほしい化学計算問題 (34) メタンの燃料電池

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
〔2023年 神戸学院大学〕
次の図は、メタンを原料として用いた燃料電池の模式図である。この燃料電池を 放電して、$4.0A$の電流を秒間流すために必要なメタンの物質量は何$mol $か。
ただし、この燃料電池の両極で起こる化学反応は、次の式で示されるものと し、メタンはすべてこの反応で消費されるものとする。
(ファラデー定数:$9.65 \times 10^4C/mol$)
負極:$CH_4+2H_2O →CO_2+8H^{+}+8e^{-}$
正極:$O_2+4H^{+}+4e^{-} →2H_2O$
この動画を見る
〔2023年 神戸学院大学〕
次の図は、メタンを原料として用いた燃料電池の模式図である。この燃料電池を 放電して、$4.0A$の電流を秒間流すために必要なメタンの物質量は何$mol $か。
ただし、この燃料電池の両極で起こる化学反応は、次の式で示されるものと し、メタンはすべてこの反応で消費されるものとする。
(ファラデー定数:$9.65 \times 10^4C/mol$)
負極:$CH_4+2H_2O →CO_2+8H^{+}+8e^{-}$
正極:$O_2+4H^{+}+4e^{-} →2H_2O$
1分で解いてほしい化学計算問題 (31) ダニエル電池

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
〔2023年 神奈川大学・改〕
$ZnSO_4$の水溶液に亜鉛板を浸したものと、$Cu^{2+}$を含む水溶液に銅板を浸したものを、
素焼き板(セパレーター)で隔てて組み合わせることでダニエル電池を作製した。
この電池を放電したところ、$1.93 \times 10^3C$の電気量が流れた。
放電により析出した金属は何$g$か。
有効数字2桁で答えなさい。
ファラデー定数:$9.65 \times 10^4C/mol Cu 63.5 Zn 65.4$
この動画を見る
〔2023年 神奈川大学・改〕
$ZnSO_4$の水溶液に亜鉛板を浸したものと、$Cu^{2+}$を含む水溶液に銅板を浸したものを、
素焼き板(セパレーター)で隔てて組み合わせることでダニエル電池を作製した。
この電池を放電したところ、$1.93 \times 10^3C$の電気量が流れた。
放電により析出した金属は何$g$か。
有効数字2桁で答えなさい。
ファラデー定数:$9.65 \times 10^4C/mol Cu 63.5 Zn 65.4$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第3問 問1 無機化学の知識問題

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
身のまわりにある元素の単体と化合物に関する記述として下線部に誤りを含 むものを、次の①~⑤のうちから一つ選べ。
① 酸化カルシウムは、水と反応して発熱するため、
携帯用の加熱剤に用いられる。
② 酸化アルミニウムは、ルビーやサファイアの主成分である。
③ 酸化チタン(IV)は、光触媒としての性質をもつため、有機物の汚れなどを分解するために利用される。
④ ヘリウムは、常温で水素についで密度が小さく、飛行船の浮揚ガスに用いられる。
⑤ 金は、化学的に非常に安定であるが、熱濃硫酸には溶ける。
この動画を見る
身のまわりにある元素の単体と化合物に関する記述として下線部に誤りを含 むものを、次の①~⑤のうちから一つ選べ。
① 酸化カルシウムは、水と反応して発熱するため、
携帯用の加熱剤に用いられる。
② 酸化アルミニウムは、ルビーやサファイアの主成分である。
③ 酸化チタン(IV)は、光触媒としての性質をもつため、有機物の汚れなどを分解するために利用される。
④ ヘリウムは、常温で水素についで密度が小さく、飛行船の浮揚ガスに用いられる。
⑤ 金は、化学的に非常に安定であるが、熱濃硫酸には溶ける。
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問6 鉛蓄電池
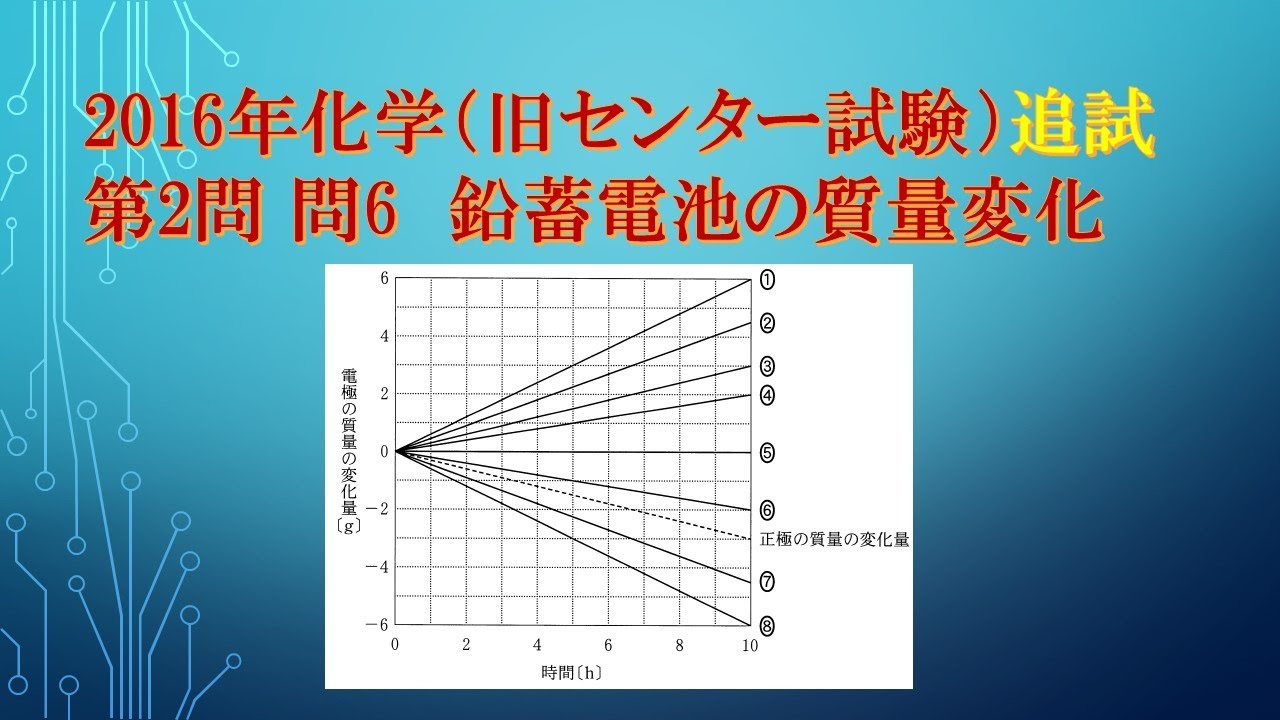
単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
鉛蓄電池に関する次の問い(a・b)に答えよ。
次の文章中のア~ウに当てはまる語句と数値の組合せとして 正しいものを、下の①~⑥のうちから一つ選べ。
鉛蓄電池の放電時には正極で$PbO_2$が$PbSO_4$になる
$\boxed{ ア }$ 反応が起こり、負極で$Pb$が$PbSO_4$になる
$\boxed{ イ }$ 反応が起こる。
正極で$1mol$の $PbSO_4$が生成するとき、 $\boxed{ ウ } mol$の電子が流れる。
※表は動画内参照
この動画を見る
鉛蓄電池に関する次の問い(a・b)に答えよ。
次の文章中のア~ウに当てはまる語句と数値の組合せとして 正しいものを、下の①~⑥のうちから一つ選べ。
鉛蓄電池の放電時には正極で$PbO_2$が$PbSO_4$になる
$\boxed{ ア }$ 反応が起こり、負極で$Pb$が$PbSO_4$になる
$\boxed{ イ }$ 反応が起こる。
正極で$1mol$の $PbSO_4$が生成するとき、 $\boxed{ ウ } mol$の電子が流れる。
※表は動画内参照
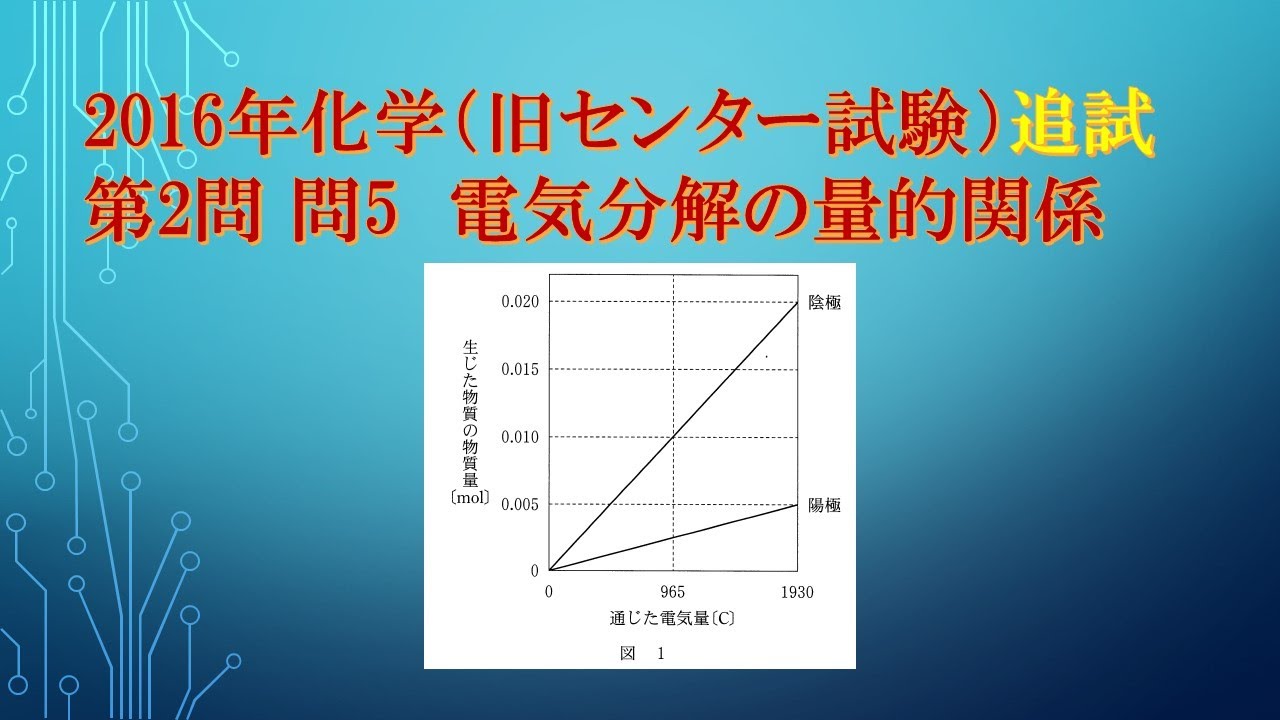
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問6 電気分解の量的関係
単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ある電解質$A$の水溶液を、白金電極を用いて電気分解したところ、通じた電気量と両極で生じた物質の物質量との関係が図のようになった。
電解質$A$として最も適当なものを、下の①~⑤のうちから一つ選べ。
①$NaCH$
②$Na_2SO_4$
③$KCI$
④$CuCI_2$
⑤$AgNO_3$
※図は動画内参照
この動画を見る
ある電解質$A$の水溶液を、白金電極を用いて電気分解したところ、通じた電気量と両極で生じた物質の物質量との関係が図のようになった。
電解質$A$として最も適当なものを、下の①~⑤のうちから一つ選べ。
①$NaCH$
②$Na_2SO_4$
③$KCI$
④$CuCI_2$
⑤$AgNO_3$
※図は動画内参照
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問6 電気分解の量的関係

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ある電解質Aの水溶液を、白金電極を用いて電気分解したところ、通じた電気量と両極で生じた物質の物質量との関係が図1のようになった。
電解質Aとして最も適当なものを、下の①~⑤のうちから一つ選べ。
①$NaOH$
②$NA_2SO_4$
③$KCI$
④$CuCI_2$
⑤$AgNO_3$
※図は動画内参照
この動画を見る
ある電解質Aの水溶液を、白金電極を用いて電気分解したところ、通じた電気量と両極で生じた物質の物質量との関係が図1のようになった。
電解質Aとして最も適当なものを、下の①~⑤のうちから一つ選べ。
①$NaOH$
②$NA_2SO_4$
③$KCI$
④$CuCI_2$
⑤$AgNO_3$
※図は動画内参照
1分で解いてほしい化学計算問題 (26) 電気分解

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
〔2023年 神戸女学院大学(改)〕
陽極に不純物を含む粗銅版を使用し、硫酸酸性の硫酸銅(Ⅱ)水溶液を$5.0A$の電流で$1.93 \times 10^3$秒電気分解した。
析出した銅の質量$〔g〕$はいくらか。
ファラデー定数を$9.65 \times 10^4C/mol$とする。
この動画を見る
〔2023年 神戸女学院大学(改)〕
陽極に不純物を含む粗銅版を使用し、硫酸酸性の硫酸銅(Ⅱ)水溶液を$5.0A$の電流で$1.93 \times 10^3$秒電気分解した。
析出した銅の質量$〔g〕$はいくらか。
ファラデー定数を$9.65 \times 10^4C/mol$とする。
1分で解いてほしい化学計算問題 (25) 鉛蓄電池の放電による質量変化

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
〔2023年 愛知工業大学(改)〕
鉛蓄電池の構成は、次のように表される。
$\begin{array}{c|c}
(-)Pb & H_2SO_{4aq} &PbO_2(+) \\
\\
\end{array}$
この電池の両極を外部回路に接続し、$2.0A$の一定電流で1時間20分25秒間放電させたとき、この放電による負極の質量の変化を$+,-$をつけて有効数字2桁で答えなさい。
(原子量:H 1 O 16 S 32 Pb 207 $,ファデラー定数 9.65 \times 10^4C/mol$)
この動画を見る
〔2023年 愛知工業大学(改)〕
鉛蓄電池の構成は、次のように表される。
$\begin{array}{c|c}
(-)Pb & H_2SO_{4aq} &PbO_2(+) \\
\\
\end{array}$
この電池の両極を外部回路に接続し、$2.0A$の一定電流で1時間20分25秒間放電させたとき、この放電による負極の質量の変化を$+,-$をつけて有効数字2桁で答えなさい。
(原子量:H 1 O 16 S 32 Pb 207 $,ファデラー定数 9.65 \times 10^4C/mol$)
【この一本でバッチリ!!】鉛蓄電池の計算問題〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
Q.鉛蓄電池を放電して、$3.86×10^3$Cの電気量を取り出した。
このとき、負極、正極、電解質溶液の質量変化をそれぞれ求めよ。
H:$1.0$,0:$16$,S:$32$,Pb:$207$, ファラデー定数F:$9.65×10^4$
この動画を見る
Q.鉛蓄電池を放電して、$3.86×10^3$Cの電気量を取り出した。
このとき、負極、正極、電解質溶液の質量変化をそれぞれ求めよ。
H:$1.0$,0:$16$,S:$32$,Pb:$207$, ファラデー定数F:$9.65×10^4$
【この一本でバッチリ!!】電気分解まとめ(電気分解基礎・計算・陽イオン交換膜法・銅の電解精錬・アルミニウムの溶融塩電解)〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
電気分解についてまとめました。
電気分解基礎・計算・陽イオン交換膜法・銅の電解精錬・アルミニウムの溶融塩電解
この動画を見る
電気分解についてまとめました。
電気分解基礎・計算・陽イオン交換膜法・銅の電解精錬・アルミニウムの溶融塩電解
【この一本でバッチリ!!】電池まとめ(ダニエル電池・ボルタ電池・鉛蓄電池・燃料電池・実用電池・リチウムイオン・電池計算)〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
電池についてまとめました。
ダニエル電池・ボルタ電池・鉛蓄電池・燃料電池・実用電池・リチウムイオン電池
この動画を見る
電池についてまとめました。
ダニエル電池・ボルタ電池・鉛蓄電池・燃料電池・実用電池・リチウムイオン電池
化学基礎の教科書を解説する動画 第63回 電池(ダニエル電池)

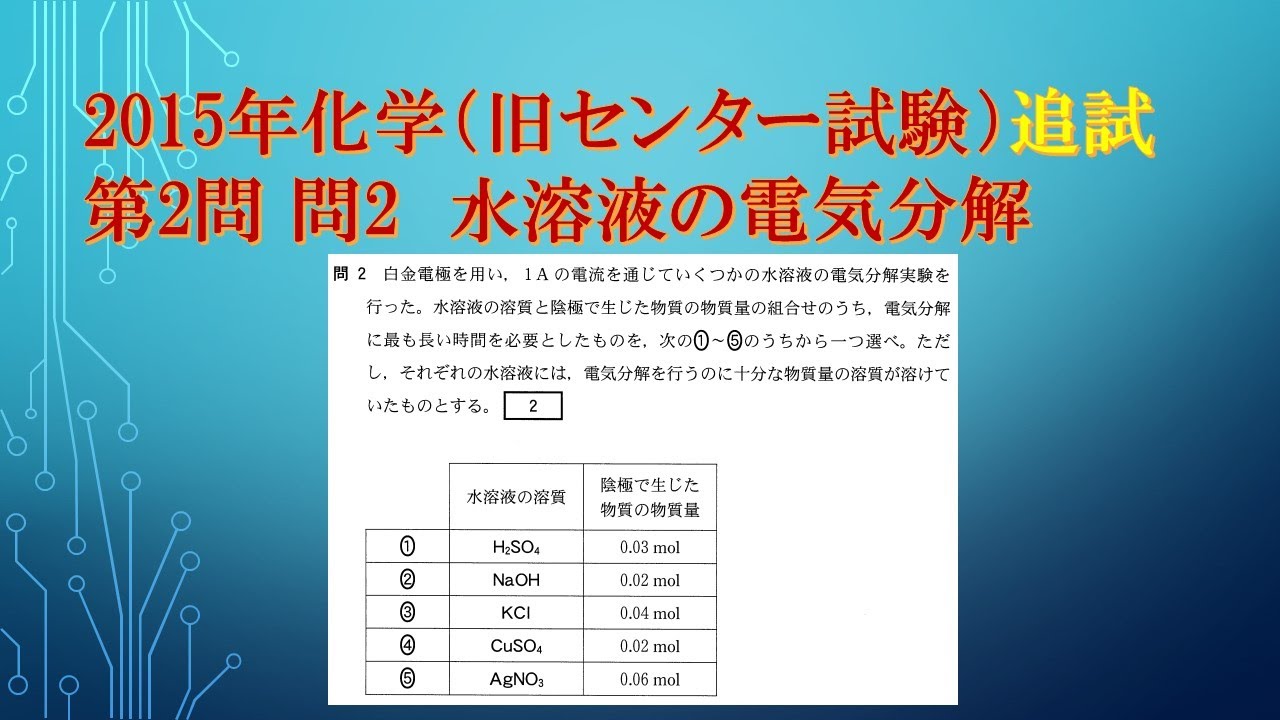
共通テスト(旧センター試験)過去問解説 化学 2015年追試 第2問 問2 水溶液の電気分解
単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
白金電極を用い、1Aの電流を通じていくつかの水溶液の電気分解実験を行った。
水溶液の溶質と陰極で生じた物質の物質量の組合せのうち、
電気分解に最も長い時間を必要としたものを、次の①~⑤のうちから一つ選べ。
ただ し、それぞれの水溶液には、電気分解を行うのに十分な物質量の溶質が溶けて いたものとする。
※表は動画内参照
この動画を見る
白金電極を用い、1Aの電流を通じていくつかの水溶液の電気分解実験を行った。
水溶液の溶質と陰極で生じた物質の物質量の組合せのうち、
電気分解に最も長い時間を必要としたものを、次の①~⑤のうちから一つ選べ。
ただ し、それぞれの水溶液には、電気分解を行うのに十分な物質量の溶質が溶けて いたものとする。
※表は動画内参照
