 理科(高校生)
理科(高校生)
 理科(高校生)
理科(高校生)
【高校物理】ビルの上から斜方投射【毎週土曜日16時更新!】

単元:
#物理#力学#理科(高校生)
教材:
#中高教材#セミナー物理基礎・物理
指導講師:
理数個別チャンネル
問題文全文(内容文):
水平な地面からの高さが39.2mのビルの屋上から、水平方向に対して30°上方に向かって、小球を速さ 19.6m/sで投げた。重力加速度の大きさを9.8m/として、次の各問に答えよ。
(1) 投げてから最高点に達するまでの時間は何sか。
(2) 小球が達する最高点は、屋上から何m上の点か。
(3) 小球を投げてから地面に達するまでの時間は何sか。
(4) 地面に落下する位置は、投射点から水平方向に何mはなれているか。
この動画を見る
水平な地面からの高さが39.2mのビルの屋上から、水平方向に対して30°上方に向かって、小球を速さ 19.6m/sで投げた。重力加速度の大きさを9.8m/として、次の各問に答えよ。
(1) 投げてから最高点に達するまでの時間は何sか。
(2) 小球が達する最高点は、屋上から何m上の点か。
(3) 小球を投げてから地面に達するまでの時間は何sか。
(4) 地面に落下する位置は、投射点から水平方向に何mはなれているか。
【共通テスト前にたった30分で要点チェック!】化学基礎の確認しておきたいポイントをこの一本で全まとめ〔現役講師解説、高校化学、化学基礎、2024年度版〕

単元:
#化学#化学基礎1ー物質の構成#化学基礎2ー物質の変化#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
化学基礎の確認しておきたいポイントをこの一本で全まとめです。
この動画を見る
化学基礎の確認しておきたいポイントをこの一本で全まとめです。
【ここからも伸びる!】共通テストまで1週間でまだやれること化学基礎・化学(動画撮影時期の都合上2週間前の話になっております)

単元:
#化学#化学基礎1ー物質の構成#化学基礎2ー物質の変化#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
共通テストまで1週間でまだやれること化学基礎・化学に関して解説していきます。
この動画を見る
共通テストまで1週間でまだやれること化学基礎・化学に関して解説していきます。
1分で解いてほしい化学計算問題 (81) 燃焼に必要な酸素の体積の計算

単元:
#化学#化学理論#気体の性質#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
メタノール$3mol$が完全燃焼するときに消費される酸素の常温($20℃$),
$1.013×10^5Pa$(1気圧)における体積として,次のうち最も近いものはどれか。
ただし,$0℃$,$1.013×10^5Pa$(1気圧)での気体$1mol$の体積は,$22.4L$とする。
①$54.2L$ ②$67.2L$ ③$100.8L$ ④$108.2L$ ⑤$216.4L$
この動画を見る
メタノール$3mol$が完全燃焼するときに消費される酸素の常温($20℃$),
$1.013×10^5Pa$(1気圧)における体積として,次のうち最も近いものはどれか。
ただし,$0℃$,$1.013×10^5Pa$(1気圧)での気体$1mol$の体積は,$22.4L$とする。
①$54.2L$ ②$67.2L$ ③$100.8L$ ④$108.2L$ ⑤$216.4L$
【旧センター試験化学】2020追試 第3問 問3 溶解度積の大小関係

単元:
#化学#化学理論#大学入試過去問(化学)#溶液の性質#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
銀イオン$Ag^+$と陰イオン$X^-,Y^-$がそれぞれ水溶液中で難溶性の塩$AgX,AgY$を生成するとき,次の反応が進行すれば,$AgY$の水への溶解度積は$AgX$より小さいことがわかる。
$AgX(固) + Y^- aq \to X^- aq + AgY(固)$
このことを用いて,$AgCl,AgI,AgSCN$の溶解度積の大小関係を調べる次の実験Ⅰ~Ⅲを行った。
実験Ⅰ 2本の試験管$A,B$にそれぞれ,$Fe(NO_3)_3$の水溶液をとった。溶液の色は黄褐色であった。
実験Ⅱ 試験管$A$の水溶液に白色の$AgSCN$の固体を加えた。さらに$KI$の水溶液を加え,よく振り交ぜて静置したところ,溶液の色は赤色になり,沈殿の色は黄色であった。
実験Ⅲ 試験管$B$の水溶液に$AgCl$の固体を加えた。さらに$KSCN$の水溶液を加えたところ,溶液の色は赤くなったが,よく振り交ぜて静置したところ,溶液の色は黄褐色になり,沈殿の色は白色であった。
実験Ⅰ~Ⅲから分かる$AgCl,AgI,AgSCN$の溶解度積の大小関係として最も適当なものを,次の①~⑥のうちから一つ選べ。
① $AgCl < AgI < AgSCN$ ② $AgCl < AgI < AgSCN$
③ $AgI < AgSCN < AgCl$ ④ $AgI < AgCl < AgSCN$
⑤ $AgSCN < AgCl < AgI$ ⑥ $AgSCN < AgI < AgCl$
この動画を見る
銀イオン$Ag^+$と陰イオン$X^-,Y^-$がそれぞれ水溶液中で難溶性の塩$AgX,AgY$を生成するとき,次の反応が進行すれば,$AgY$の水への溶解度積は$AgX$より小さいことがわかる。
$AgX(固) + Y^- aq \to X^- aq + AgY(固)$
このことを用いて,$AgCl,AgI,AgSCN$の溶解度積の大小関係を調べる次の実験Ⅰ~Ⅲを行った。
実験Ⅰ 2本の試験管$A,B$にそれぞれ,$Fe(NO_3)_3$の水溶液をとった。溶液の色は黄褐色であった。
実験Ⅱ 試験管$A$の水溶液に白色の$AgSCN$の固体を加えた。さらに$KI$の水溶液を加え,よく振り交ぜて静置したところ,溶液の色は赤色になり,沈殿の色は黄色であった。
実験Ⅲ 試験管$B$の水溶液に$AgCl$の固体を加えた。さらに$KSCN$の水溶液を加えたところ,溶液の色は赤くなったが,よく振り交ぜて静置したところ,溶液の色は黄褐色になり,沈殿の色は白色であった。
実験Ⅰ~Ⅲから分かる$AgCl,AgI,AgSCN$の溶解度積の大小関係として最も適当なものを,次の①~⑥のうちから一つ選べ。
① $AgCl < AgI < AgSCN$ ② $AgCl < AgI < AgSCN$
③ $AgI < AgSCN < AgCl$ ④ $AgI < AgCl < AgSCN$
⑤ $AgSCN < AgCl < AgI$ ⑥ $AgSCN < AgI < AgCl$
【旧センター試験化学】2020追試 第3問 問2 酸化物の性質

単元:
#化学#大学入試過去問(化学)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
酸化物やオキソ酸に関する記述として下線部に誤りを含むものを,次の①~⑤のうちから一つ選べ。
① アルカリ金属元素の酸化物は, 塩基性酸化物である 。
② 非金属元素の酸化物の多くは,酸性酸化物である。
③ 酸性酸化物と水の反応によって生じる酸の多くは,オキソ酸である。
④ 同一元素のオキソ酸は,中心の原子の酸化数が大きくなり,結合している酸素原子の数が多くなるほど,弱い酸になる。
⑤ 金属元素の酸化物の中には,酸と塩基のいずれとも反応して塩をつくる両性酸化物がある。
この動画を見る
酸化物やオキソ酸に関する記述として下線部に誤りを含むものを,次の①~⑤のうちから一つ選べ。
① アルカリ金属元素の酸化物は, 塩基性酸化物である 。
② 非金属元素の酸化物の多くは,酸性酸化物である。
③ 酸性酸化物と水の反応によって生じる酸の多くは,オキソ酸である。
④ 同一元素のオキソ酸は,中心の原子の酸化数が大きくなり,結合している酸素原子の数が多くなるほど,弱い酸になる。
⑤ 金属元素の酸化物の中には,酸と塩基のいずれとも反応して塩をつくる両性酸化物がある。
【旧センター試験化学】2020追試 第3問 問1 無機物質の性質

単元:
#大学入試過去問(化学)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
身の回り無機物質に関する記述として下線部に誤りを含むものを,次の①~④のうちから一つ選べ。
①単体のヨウ素は,水に溶けやすく酸化作用を示し,殺菌消毒剤などに用いられる。
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
②塩化マグネシウムは,豆乳中のタンパク質を塩析させるので,豆腐の製造に用いられる。
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
③クロムは,空気中で表面に緻密な酸化被膜をつくるので,鉄の表面をクロムめっきすることで鉄さびを防止する
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
④単体のケイ素は,ダイヤモンドと同様に結晶構造をもち,半導体の性質を示すので,集積回路に用いられる
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
この動画を見る
身の回り無機物質に関する記述として下線部に誤りを含むものを,次の①~④のうちから一つ選べ。
①単体のヨウ素は,水に溶けやすく酸化作用を示し,殺菌消毒剤などに用いられる。
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
②塩化マグネシウムは,豆乳中のタンパク質を塩析させるので,豆腐の製造に用いられる。
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
③クロムは,空気中で表面に緻密な酸化被膜をつくるので,鉄の表面をクロムめっきすることで鉄さびを防止する
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
④単体のケイ素は,ダイヤモンドと同様に結晶構造をもち,半導体の性質を示すので,集積回路に用いられる
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
【今から20点UP】数学・理科の授業動画、一挙紹介!

酸化還元反応でないものは?

単元:
#化学#化学基礎2ー物質の変化#酸化還元反応#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
酸化還元反応でないものはどれか。
a CaCO₃+2HCl→CaCl₂+CO₂+H₂O
b Cu+Cl₂→CuCl₂
c H₂O₂+2KI+H₂SO₄→2H₂O+I₂+K₂SO₄
d 2H₂S+SO₂→3S+2H₂O
e Fe₂O₃+2Al→2Fe+Al₂O₃
この動画を見る
酸化還元反応でないものはどれか。
a CaCO₃+2HCl→CaCl₂+CO₂+H₂O
b Cu+Cl₂→CuCl₂
c H₂O₂+2KI+H₂SO₄→2H₂O+I₂+K₂SO₄
d 2H₂S+SO₂→3S+2H₂O
e Fe₂O₃+2Al→2Fe+Al₂O₃
【旧センター試験化学】2020追試 第2問 問3 水溶液の電気分解

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
Cl:35.5 Cu:64
炭素棒を電極として用い,塩化銅($Ⅱ$)水溶液の電気分解を行った。$0.50 A$の一定電流を$965$ 秒間流したとき,陰極で生じた物質の質量〔$g$〕として最も適当なものを,次の①~⑤のうちから一つ選べ。ただし,電気分解を行うために十分な量の塩化銅($Ⅱ$)が溶けていたものとし,ファラデー定数は$9.65×10^4 C/mol$とする。また,流れた電流はすべて塩化銅($Ⅱ$)の電気分解に使われたものとする。
この動画を見る
Cl:35.5 Cu:64
炭素棒を電極として用い,塩化銅($Ⅱ$)水溶液の電気分解を行った。$0.50 A$の一定電流を$965$ 秒間流したとき,陰極で生じた物質の質量〔$g$〕として最も適当なものを,次の①~⑤のうちから一つ選べ。ただし,電気分解を行うために十分な量の塩化銅($Ⅱ$)が溶けていたものとし,ファラデー定数は$9.65×10^4 C/mol$とする。また,流れた電流はすべて塩化銅($Ⅱ$)の電気分解に使われたものとする。
絶対に落としてはいけない計算 シュウ酸溶液の調製の計算問題
単元:
#化学#化学基礎2ー物質の変化#物質量と濃度#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
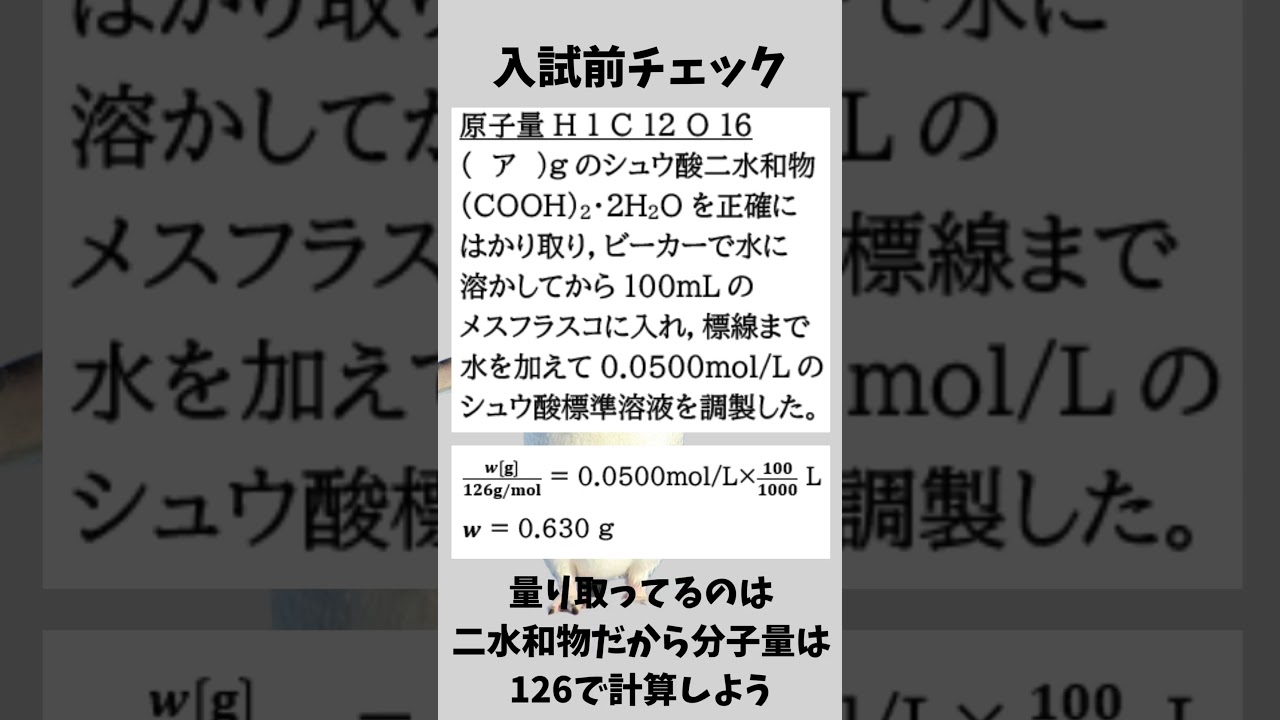
原子量H:1 C:12 O:16
(ア)gのシュウ酸二水和物$(COOH)_2・2H_2O$を正確にはかり取り,ビーカーで水に溶かしてから100 mLのメスフラスコに入れ,標線まで水を加えて0.0500 mol/Lのシュウ酸標準溶液を調整した
空欄アに入る数値を有効数字3桁で答えよ。
この動画を見る
原子量H:1 C:12 O:16
(ア)gのシュウ酸二水和物$(COOH)_2・2H_2O$を正確にはかり取り,ビーカーで水に溶かしてから100 mLのメスフラスコに入れ,標線まで水を加えて0.0500 mol/Lのシュウ酸標準溶液を調整した
空欄アに入る数値を有効数字3桁で答えよ。
【解答速報・全問解説】2025年 神奈川大学給費生試験 生物解答速報【TAKAHASHI名人】

単元:
#生物#大学入試過去問(生物)#私立大#理科(高校生)#大学入試解答速報#生物#神奈川大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
こちらの動画は、2024年12月22日(日)に実施された、2025年神奈川大学給費生試験の生物の解答速報です。
■解答
大問1
問1 ①DNAヘリカーゼ②プライマー③DNAポリメラーゼ④リーディング鎖⑤ラギング鎖⑥岡崎フラグメント
問2(1)f
(2)性質や形が異なる体細胞でももとをたどると受精卵という一つの細胞から分裂したものになるため。
問3(1)アデニンはチミンとグアニンはシトシンと特定の塩基同士で水素結合する性質
(2)一方の鎖を鋳型として利用して他方を構築するために損傷などが起きた際の修復することが可能であること。
問4 1c(塩基)3a(ヒドロキシ基) 5d(リン酸)
問5(1)チミンとウラシル デオキシリボースとリボース
(2)RNAは一本鎖のため修復が難しいため遺伝情報が失われてしまう。
大問2
問1(1)頂芽優勢(2)オーキシン(3)上方へ行くことでより高く明るい場所に到達するため植物同士の光をめぐる競争に有利に働く
問2a×b〇c〇d×
問3(1)アミロプラスト(2)b
問4 茎が太くなることにより、外部からの力に強くなることと、内部の菅が太くなり輸送量が増える。
問5(1)維管束系(2)シダ植物
問6(1)フォトトロピン(2)細胞内にカリウムイオンが取り込まれ、細胞内の浸透圧が上昇することで水分が細胞に入り膨圧が増加し気孔が開く。
問7 cef
問8 b
大問3
問1①中枢②生得的③かぎ刺激④走性⑤脱慣れ 今回は鋭敏化にしなかったのは、電気刺激が強いがなかった点と弱い刺激でもがなかったためです。
問2 c
問3 (1)無駄なエネルギー消費を減らせる(2)bc
問4 エネルギー仮説 b
視覚刺激仮説 d
問5 延長処理 15.3 足切断処理 5.1
問6 距離に関しては全て同じになる。理由 あくまでB地点までの距離を歩幅×歩数で保存しているだけになり、トレーニングをしたため変化しない。
この動画を見る
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
こちらの動画は、2024年12月22日(日)に実施された、2025年神奈川大学給費生試験の生物の解答速報です。
■解答
大問1
問1 ①DNAヘリカーゼ②プライマー③DNAポリメラーゼ④リーディング鎖⑤ラギング鎖⑥岡崎フラグメント
問2(1)f
(2)性質や形が異なる体細胞でももとをたどると受精卵という一つの細胞から分裂したものになるため。
問3(1)アデニンはチミンとグアニンはシトシンと特定の塩基同士で水素結合する性質
(2)一方の鎖を鋳型として利用して他方を構築するために損傷などが起きた際の修復することが可能であること。
問4 1c(塩基)3a(ヒドロキシ基) 5d(リン酸)
問5(1)チミンとウラシル デオキシリボースとリボース
(2)RNAは一本鎖のため修復が難しいため遺伝情報が失われてしまう。
大問2
問1(1)頂芽優勢(2)オーキシン(3)上方へ行くことでより高く明るい場所に到達するため植物同士の光をめぐる競争に有利に働く
問2a×b〇c〇d×
問3(1)アミロプラスト(2)b
問4 茎が太くなることにより、外部からの力に強くなることと、内部の菅が太くなり輸送量が増える。
問5(1)維管束系(2)シダ植物
問6(1)フォトトロピン(2)細胞内にカリウムイオンが取り込まれ、細胞内の浸透圧が上昇することで水分が細胞に入り膨圧が増加し気孔が開く。
問7 cef
問8 b
大問3
問1①中枢②生得的③かぎ刺激④走性⑤脱慣れ 今回は鋭敏化にしなかったのは、電気刺激が強いがなかった点と弱い刺激でもがなかったためです。
問2 c
問3 (1)無駄なエネルギー消費を減らせる(2)bc
問4 エネルギー仮説 b
視覚刺激仮説 d
問5 延長処理 15.3 足切断処理 5.1
問6 距離に関しては全て同じになる。理由 あくまでB地点までの距離を歩幅×歩数で保存しているだけになり、トレーニングをしたため変化しない。
高校化学 入試直前チェック 化学平衡 アルゴンを入れると平衡はどちらに移動するか問題

単元:
#化学#化学平衡と平衡移動
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
$N_2 + 3H_2 ⇄ 2NH_3$
上の平衡反応において温度一定で次のように条件を変える。平衡は移動するか?
①体積一定で$Ar$を加えたとき
②全圧一定で$Ar$を加えたとき
この動画を見る
$N_2 + 3H_2 ⇄ 2NH_3$
上の平衡反応において温度一定で次のように条件を変える。平衡は移動するか?
①体積一定で$Ar$を加えたとき
②全圧一定で$Ar$を加えたとき
【保存版】科学的にお風呂の鏡をきれいにする方法

【解答速報・全問解説】2025年 神奈川大学給費生試験 化学解答速報【化学のタカシー】

単元:
#化学#大学入試過去問(化学)#理科(高校生)#神奈川大学#大学入試解答速報#化学#神奈川大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
こちらの動画は、2024年12月22日(日)に実施された、2025年神奈川大学給費生試験の化学の解答速報です。
解説者は理数個別指導学院宮崎台校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
この動画を見る
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
こちらの動画は、2024年12月22日(日)に実施された、2025年神奈川大学給費生試験の化学の解答速報です。
解説者は理数個別指導学院宮崎台校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
【解答速報・全問解説】2025年 神奈川大学給費生試験 物理解答速報【理数大明神

単元:
#物理#大学入試過去問(物理)#理科(高校生)#大学入試解答速報#物理#神奈川大学#神奈川大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
こちらの動画は、2024年12月22日(日)に実施された、2025年神奈川大学給費生試験の物理の解答速報です。
※解説訂正※
大問1の(2)ですが、
「小物体Bの小物体Aに対する相対速度」なので
ーu=VbーVaとするのが正しく、正解は④となります。申し訳ございません。
大問2の(1)(イ)ですが、
文字の指定が無いためばね定数kやL、x₀などを用いて答えても正解かと思われます。
こちらは当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
この動画を見る
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
こちらの動画は、2024年12月22日(日)に実施された、2025年神奈川大学給費生試験の物理の解答速報です。
※解説訂正※
大問1の(2)ですが、
「小物体Bの小物体Aに対する相対速度」なので
ーu=VbーVaとするのが正しく、正解は④となります。申し訳ございません。
大問2の(1)(イ)ですが、
文字の指定が無いためばね定数kやL、x₀などを用いて答えても正解かと思われます。
こちらは当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
【旧センター試験化学・新課程対応】2020追試 第2問 問1 生成エンタルピー

単元:
#化学#化学理論#物質の変化と熱・光#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
メタノールノール CH3OH (液)とエタノール C2H5OH(液)の生成エンタルピーと燃焼エンタルピーを表に示す。CO₂(気)とH₂O (液)の生成エンタルピーはそれぞれ何 kJ/molか。最も適当な数値を下の①~⑥から一つずつ選べ。
生成エンタルピー (kJ/mol) 燃焼エンタルビー (kJ/mol)
CH₂OH(液) -239 -727
C₂H₂OH(液) -278 -1368
①-572 ②-1143 ③-1434 ④-2865 ⑤-394 ⑥-716
この動画を見る
メタノールノール CH3OH (液)とエタノール C2H5OH(液)の生成エンタルピーと燃焼エンタルピーを表に示す。CO₂(気)とH₂O (液)の生成エンタルピーはそれぞれ何 kJ/molか。最も適当な数値を下の①~⑥から一つずつ選べ。
生成エンタルピー (kJ/mol) 燃焼エンタルビー (kJ/mol)
CH₂OH(液) -239 -727
C₂H₂OH(液) -278 -1368
①-572 ②-1143 ③-1434 ④-2865 ⑤-394 ⑥-716
無機化学基礎演習(19) ハロゲン単体・化合物の性質

単元:
#化学#無機#大学入試過去問(化学)#非金属元素の単体と化合物#理科(高校生)#神奈川大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
次の(1)~(5)の文中の空欄(a)~(e)にあてはまるもっとも適当なものを選択肢の中から1つずつ選びなさい。
(1)ハロゲンの単体のうち,沸点が最も低いものは(a)である。
①$Br_2$ ②$Cl_2$ ③$F_2$ ④$I_2$
(2)ハロゲンの単体のうち,水ともっとも激しく反応するものは(b)である。
①$Br_2$ ②$Cl_2$ ③$F_2$ ④$I_2$
(3)フッ化水素は(c)に濃硫酸を加えて加熱することで製造される。
①沸騰石 ②石灰石 ③ホタル石 ④ボーキサイト
(4)ハロゲン化水素のうち,沸点がもっとも高いものは(d)である。
①$HBr$ ②$HCl$ ③$HF$ ④$HI$
(5)塩素のオキソ酸のうち,酸性がもっとも強いものは(e)である。
①亜塩素酸 ②塩素酸 ③過塩素酸 ④過塩素酸
この動画を見る
次の(1)~(5)の文中の空欄(a)~(e)にあてはまるもっとも適当なものを選択肢の中から1つずつ選びなさい。
(1)ハロゲンの単体のうち,沸点が最も低いものは(a)である。
①$Br_2$ ②$Cl_2$ ③$F_2$ ④$I_2$
(2)ハロゲンの単体のうち,水ともっとも激しく反応するものは(b)である。
①$Br_2$ ②$Cl_2$ ③$F_2$ ④$I_2$
(3)フッ化水素は(c)に濃硫酸を加えて加熱することで製造される。
①沸騰石 ②石灰石 ③ホタル石 ④ボーキサイト
(4)ハロゲン化水素のうち,沸点がもっとも高いものは(d)である。
①$HBr$ ②$HCl$ ③$HF$ ④$HI$
(5)塩素のオキソ酸のうち,酸性がもっとも強いものは(e)である。
①亜塩素酸 ②塩素酸 ③過塩素酸 ④過塩素酸
【高校化学】アニリンの性質【毎週土曜日16時更新!】

単元:
#化学#有機#有機化合物の特徴と構造#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
アニリンに関する次の記述のうち,誤っているものを2つ選べ。
(ア)アニリンに硫酸酸性のニクロム酸カリウム水溶液を反応させると,黒色の染料であるアニリンブラックが生じる。
(イ)アニリンを無水酢酸と反応させると, アセトアニリドが生じる。
(ウ)アニリン塩酸塩水溶液に希硝酸を加えると,塩化ベンゼンジアゾニウムが生じる。
(エ)アニリンに塩化鉄(Ⅲ) 水溶液を加えると, 赤紫色になる。
(オ)アニリン塩酸塩水溶液に水酸化ナトリウム水溶液を加えると, 弱塩基のアニリンが遊離する。
この動画を見る
アニリンに関する次の記述のうち,誤っているものを2つ選べ。
(ア)アニリンに硫酸酸性のニクロム酸カリウム水溶液を反応させると,黒色の染料であるアニリンブラックが生じる。
(イ)アニリンを無水酢酸と反応させると, アセトアニリドが生じる。
(ウ)アニリン塩酸塩水溶液に希硝酸を加えると,塩化ベンゼンジアゾニウムが生じる。
(エ)アニリンに塩化鉄(Ⅲ) 水溶液を加えると, 赤紫色になる。
(オ)アニリン塩酸塩水溶液に水酸化ナトリウム水溶液を加えると, 弱塩基のアニリンが遊離する。
【高校物理】斜面上のばね振り子【毎週土曜日16時更新!】

単元:
#物理#力学#理科(高校生)
教材:
#中高教材#セミナー物理基礎・物理
指導講師:
理数個別チャンネル
問題文全文(内容文):
図のように、水平面との傾きがθのなめらかな面上に、ばね定数kの軽いばねを置く。ばねの一端を斜面上に固定し、他端に質量mのおもりをつけて、斜面上で単振動をさせる。重力加速度の大きさをgとして、次の各問に答えよ。
(1) 単振動の中心は、ばねの伸びがいくらになったところか。
(2) 単振動の周期を求めよ。
この動画を見る
図のように、水平面との傾きがθのなめらかな面上に、ばね定数kの軽いばねを置く。ばねの一端を斜面上に固定し、他端に質量mのおもりをつけて、斜面上で単振動をさせる。重力加速度の大きさをgとして、次の各問に答えよ。
(1) 単振動の中心は、ばねの伸びがいくらになったところか。
(2) 単振動の周期を求めよ。
【旧センター試験化学】2020追試 第1問 問5 凝固点降下度

単元:
#化学#大学入試過去問(化学)#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
物質A,B,Cについて,それぞれ質量モル濃度0.10 mol/kgの水溶液をつくり,凝固点降下度を測定した。その結果を以下に示す。ただし,物質A,B,Cは,2種類の電解質(電離度1)と1種類の非電解質である。この実験結果から推測される記述として,誤りを含むものを,下の①~④のうちから一つ選べ。
凝固点降下度〔K〕
物質Aの水溶液:0.57 物質Bの水溶液:0.19 物質Cの水溶液:0.38
①0.010 mol/kgのグルコース水溶液の凝固点降下度は0.019 Kである。
②0.010 mol/kgの酢酸水溶液の凝固点降下度は0.038 Kである。
③0.010 mol/kgの塩化カリウム水溶液の凝固点降下度は0.038 Kである。
④0.010 mol/kgの塩化マグネシウム水溶液の凝固点降下度は0.057 Kである。
この動画を見る
物質A,B,Cについて,それぞれ質量モル濃度0.10 mol/kgの水溶液をつくり,凝固点降下度を測定した。その結果を以下に示す。ただし,物質A,B,Cは,2種類の電解質(電離度1)と1種類の非電解質である。この実験結果から推測される記述として,誤りを含むものを,下の①~④のうちから一つ選べ。
凝固点降下度〔K〕
物質Aの水溶液:0.57 物質Bの水溶液:0.19 物質Cの水溶液:0.38
①0.010 mol/kgのグルコース水溶液の凝固点降下度は0.019 Kである。
②0.010 mol/kgの酢酸水溶液の凝固点降下度は0.038 Kである。
③0.010 mol/kgの塩化カリウム水溶液の凝固点降下度は0.038 Kである。
④0.010 mol/kgの塩化マグネシウム水溶液の凝固点降下度は0.057 Kである。
【旧センター試験化学】2020追試 第1問 問5 凝固点降下度

単元:
#化学#化学基礎2ー物質の変化#物質量と濃度#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
物質A,B,Cについて,それぞれ質量モル濃度0.10mol/kgの水溶液をつくり,凝固点降下度を測定した。その結果を表3に示す。(※表は動画内参照)ただし,物質A,B,Cは2種類の電解質(電解質1)と1種類の非電解質である。この実験結果から推測される記述として,誤りを含むものを,下の①~④のうちから一つ選べ。
①0.010mol/kgのグルコース水溶液の凝固点降下度は0.019Kである。
②0.010mol/kgの酢酸水溶液の凝固点降下度は0.038Kである。
③0.010mol/kgの塩化カリウム水溶液の凝固点降下度は0.038Kである。
④0.010mol/kgの塩化マグネシウム水溶液の凝固点降下度は0.057Kである。
この動画を見る
物質A,B,Cについて,それぞれ質量モル濃度0.10mol/kgの水溶液をつくり,凝固点降下度を測定した。その結果を表3に示す。(※表は動画内参照)ただし,物質A,B,Cは2種類の電解質(電解質1)と1種類の非電解質である。この実験結果から推測される記述として,誤りを含むものを,下の①~④のうちから一つ選べ。
①0.010mol/kgのグルコース水溶液の凝固点降下度は0.019Kである。
②0.010mol/kgの酢酸水溶液の凝固点降下度は0.038Kである。
③0.010mol/kgの塩化カリウム水溶液の凝固点降下度は0.038Kである。
④0.010mol/kgの塩化マグネシウム水溶液の凝固点降下度は0.057Kである。
整数問題の難問!誘導なしで解けたらすごい! #Shorts #ずんだもん #勉強 #数学

単元:
#数A#大学入試過去問(数学)#整数の性質#約数・倍数・整数の割り算と余り・合同式#学校別大学入試過去問解説(数学)#数学(高校生)#大阪医科薬科大学
指導講師:
数学・算数の楽しさを思い出した / Ken
問題文全文(内容文):
3^x-2^y=1をみたす自然数x,yの組をすべて求めよ。
この動画を見る
3^x-2^y=1をみたす自然数x,yの組をすべて求めよ。
1分で解いてほしい化学計算問題 (78) 混合気体の燃焼に必要な酸素の量

単元:
#化学#化学基礎2ー物質の変化#化学変化と化学反応式
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
水素とメタンの物質量の比が2:1の混合気体が0℃,1.013×10^5Paで3.0Lである。これを完全燃焼させるには,0℃,1.013×10^5Paの空気は何L必要か。
(空気中に酸素は20%含まれるものとする)
この動画を見る
水素とメタンの物質量の比が2:1の混合気体が0℃,1.013×10^5Paで3.0Lである。これを完全燃焼させるには,0℃,1.013×10^5Paの空気は何L必要か。
(空気中に酸素は20%含まれるものとする)
冷蔵庫はなぜ冷たくなるのか?

【旧センター試験化学】2020追試 第1問 問3 体積と圧力の関係

単元:
#化学#化学理論#気体の性質
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
センター試験化学2020追試 問3
ある純物質Xを図1(図は動画参照)のような容器に閉じ込め,一定温度で容器の体積Vを変えて容器内の圧力Pを測定した。図2(図は動画参照)に,物質XのPとVの関係を示す。ここで,A点では,物質Xはすべて気体であり,実在気体としてふるまう。物質XのPとVに関する記述として,誤りを含むものを,次の①~④のうちから一つ選べ。
①A点から体積Vを増加させ圧力Pを十分低くすると,物質Xは理想気体に近いふるまいをする。
②A点から体積Vを減少させると,B点で気体Xの凝縮が始まる。
③B点とC点の間では,体積Vを減少させても,物質Xの気体の分子数は一定に保たれる。
④C点では,物質Xはすべて液体であり,体積Vをさらに減少させると,圧力Pは急激に減少する。
この動画を見る
センター試験化学2020追試 問3
ある純物質Xを図1(図は動画参照)のような容器に閉じ込め,一定温度で容器の体積Vを変えて容器内の圧力Pを測定した。図2(図は動画参照)に,物質XのPとVの関係を示す。ここで,A点では,物質Xはすべて気体であり,実在気体としてふるまう。物質XのPとVに関する記述として,誤りを含むものを,次の①~④のうちから一つ選べ。
①A点から体積Vを増加させ圧力Pを十分低くすると,物質Xは理想気体に近いふるまいをする。
②A点から体積Vを減少させると,B点で気体Xの凝縮が始まる。
③B点とC点の間では,体積Vを減少させても,物質Xの気体の分子数は一定に保たれる。
④C点では,物質Xはすべて液体であり,体積Vをさらに減少させると,圧力Pは急激に減少する。
【旧センター試験化学】2019追試 第1問 問6 コロイドの生成実験

単元:
#化学#大学入試過去問(化学)#センター試験
指導講師:
問題文全文(内容文):
センター試験 2019 追試 第1問 問6
塩化鉄(Ⅲ)水溶液を沸騰水に加えて水酸化鉄(Ⅲ)のコロイド溶液を生成させた。このコロイド溶液をセロハンの袋に入れ,図1に示すように純水中で透析した後,次の実験Ⅰ・Ⅱを行った。これらの実験に関する記述として誤りを含むものを,次の①~④のうちから一つ選べ。
実験Ⅰ
(1) 透析後のコロイド溶液を3 mlずつ試験管A・Bにとった。
(2) Aに0.1 mol/Lの$Na_2SO_4$水溶液を加えると,沈殿が生じた。
(3) Bに0.2 mol/Lの$NaCl$水溶液を少量加えても,変化が生じなかった。
実験Ⅱ
(1) 透析後のビーカーに残った水を3 mlずつ試験管C・Dにとった。
(2) Cに硝酸銀水溶液を加えると,白濁した。
(3) DにBTB(ブロモチモールブルー)溶液を加えると,黄色に変色した。
①実験Ⅰより,このコロイド粒子は負に帯電していることがわかる。
②実験Ⅰより,$Na_2SO_4$水溶液の代わりに0.1 mol/Lの$K_2SO_4$水溶液を少量加えても,沈殿が生じることがわかる。
③実験Ⅱより,透析により塩化物イオンがセロハンを通過したことがわかる。
④実験Ⅱより,透析により水素イオンがセロハンを通過したことがわかる。
この動画を見る
センター試験 2019 追試 第1問 問6
塩化鉄(Ⅲ)水溶液を沸騰水に加えて水酸化鉄(Ⅲ)のコロイド溶液を生成させた。このコロイド溶液をセロハンの袋に入れ,図1に示すように純水中で透析した後,次の実験Ⅰ・Ⅱを行った。これらの実験に関する記述として誤りを含むものを,次の①~④のうちから一つ選べ。
実験Ⅰ
(1) 透析後のコロイド溶液を3 mlずつ試験管A・Bにとった。
(2) Aに0.1 mol/Lの$Na_2SO_4$水溶液を加えると,沈殿が生じた。
(3) Bに0.2 mol/Lの$NaCl$水溶液を少量加えても,変化が生じなかった。
実験Ⅱ
(1) 透析後のビーカーに残った水を3 mlずつ試験管C・Dにとった。
(2) Cに硝酸銀水溶液を加えると,白濁した。
(3) DにBTB(ブロモチモールブルー)溶液を加えると,黄色に変色した。
①実験Ⅰより,このコロイド粒子は負に帯電していることがわかる。
②実験Ⅰより,$Na_2SO_4$水溶液の代わりに0.1 mol/Lの$K_2SO_4$水溶液を少量加えても,沈殿が生じることがわかる。
③実験Ⅱより,透析により塩化物イオンがセロハンを通過したことがわかる。
④実験Ⅱより,透析により水素イオンがセロハンを通過したことがわかる。
【高校化学】けん化価とヨウ素価【毎週土曜日16時更新!】

単元:
#化学#有機#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
油脂1gのけん化に要する水酸化カリウムの質量[mg]をけん化価といい,油脂 100g に付加するヨウ素の質量[g] をヨウ素価という。
次の各問いに答えよ。 ただし, KOH の式量を56, I2 の分子量を254とする。
(1) 油脂Xのけん化価は190であった。油脂Xの分子量を有効数字3桁で答えよ。
(2)油脂Xのヨウ素価が86.2であるとき,油脂Xの分子内には,いくつの炭素-炭素二重結合が含まれているか。 ただし, 油脂Xの分子内には,炭素-炭素三重結合は含まれていないものとする。
この動画を見る
油脂1gのけん化に要する水酸化カリウムの質量[mg]をけん化価といい,油脂 100g に付加するヨウ素の質量[g] をヨウ素価という。
次の各問いに答えよ。 ただし, KOH の式量を56, I2 の分子量を254とする。
(1) 油脂Xのけん化価は190であった。油脂Xの分子量を有効数字3桁で答えよ。
(2)油脂Xのヨウ素価が86.2であるとき,油脂Xの分子内には,いくつの炭素-炭素二重結合が含まれているか。 ただし, 油脂Xの分子内には,炭素-炭素三重結合は含まれていないものとする。
【高校物理】単振動とエネルギー【毎週土曜日16時更新!】

単元:
#物理#力学#理科(高校生)
教材:
#中高教材#セミナー物理基礎・物理
指導講師:
理数個別チャンネル
問題文全文(内容文):
質量5.0kgの物体が、周期4.0s、振幅2.0mの単振動をしている。この単振動について、次の各間に答えよ。
(1)角振動数は何 rad/s か。
(2)振動数は何 Hzか。
(3)変位が1.0mの点で、物体が受ける復元力の大きさは何か。
(4)物体が受ける復元力の大きさの最大値は何Nか。
(5)単振動のエネルギーは何Jか。
この動画を見る
質量5.0kgの物体が、周期4.0s、振幅2.0mの単振動をしている。この単振動について、次の各間に答えよ。
(1)角振動数は何 rad/s か。
(2)振動数は何 Hzか。
(3)変位が1.0mの点で、物体が受ける復元力の大きさは何か。
(4)物体が受ける復元力の大きさの最大値は何Nか。
(5)単振動のエネルギーは何Jか。
【旧センター試験化学】2020追試 第1問 問2 メタンハイドレート

単元:
#化学#化学理論#大学入試過去問(化学)#気体の性質#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
センター試験化学 2020追試 第1問 問2
メタン$CH_4$は,定温・高圧下で水分子がつくる網目状構造に取り込まれて固体物質を形成する。この固体物質はメタンハイドレートと呼ばれ,$CH_4$と$H_2O$の質量比が16:104であることが知られている。
メタンハイドレート1.20 gのみが入っている容積1.0 Lの密閉容器を,27 ℃で静置したところ,メタンハイドレートは$CH_4$(気),$H_2O$(気),$H_2O$(液)となった。このとき,容器内の気体の全圧は何 Paか。最も適当な数値を,次の①~⑤のうちから一つ選べ。ただし,気体定数は$R=8.3 × 10^3 Pa・L/(K・mol)$であり,27 ℃における水蒸気圧は$3.6 × 10^3 Pa$である。また,$H_2O$(液)の体積,$H_2O$(液)への$CH_4$(気)の溶解は無視できるものとする。
① $3.6 × 10^3$ ② $2.5 × 10^4$ ③ $2.9 × 10^4$
④ $1.4 × 10^5$ ⑤ $1.7 × 10^5$
この動画を見る
センター試験化学 2020追試 第1問 問2
メタン$CH_4$は,定温・高圧下で水分子がつくる網目状構造に取り込まれて固体物質を形成する。この固体物質はメタンハイドレートと呼ばれ,$CH_4$と$H_2O$の質量比が16:104であることが知られている。
メタンハイドレート1.20 gのみが入っている容積1.0 Lの密閉容器を,27 ℃で静置したところ,メタンハイドレートは$CH_4$(気),$H_2O$(気),$H_2O$(液)となった。このとき,容器内の気体の全圧は何 Paか。最も適当な数値を,次の①~⑤のうちから一つ選べ。ただし,気体定数は$R=8.3 × 10^3 Pa・L/(K・mol)$であり,27 ℃における水蒸気圧は$3.6 × 10^3 Pa$である。また,$H_2O$(液)の体積,$H_2O$(液)への$CH_4$(気)の溶解は無視できるものとする。
① $3.6 × 10^3$ ② $2.5 × 10^4$ ③ $2.9 × 10^4$
④ $1.4 × 10^5$ ⑤ $1.7 × 10^5$
