 化学平衡と平衡移動
化学平衡と平衡移動
 化学平衡と平衡移動
化学平衡と平衡移動
理論化学基礎演習52 中和反応とpH

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
2025 北海道大学
log2= 0.3 * log3= 0.48 * log7 = 0.85
0.14mol/Lの酢酸水溶液15mLを0.070mol/Lの水酸化ナトリウム水溶液で滴定した。滴下開始直後はpHの変化がやや大きくなった。その後、中和点付近までは滴下量を増やしてもpHの変化は小さかった。これは、酢酸と酢酸ナトリウムの両方が含まれた水溶液にOH-を少量滴下しても、水溶液中のOH-の濃度はほとんど増加しないためである。このような溶液を[ 」という。酢酸に対して十分な量の 「酢酸ナトリウムが含まれている場合には、酢酸イオン濃度が高いため、酢酸はほとんど電離していないと考えることができる。
(1) 下線部(i)について、完全に中和するために必要な水酸化ナトリウム水溶液の体積(mL)を有効数字2桁で答えよ。
(2) 下線部(ii)を表す適切な反応式をOH-を用いて答えよ。
(3)空欄[]にあてはまる適切な語句を答えよ。
(4) 水酸化ナトリウム水溶液を20mL滴下したときの混合水溶液のpHを計算し、 小数第一位まで答えよ。酢酸の電離定数は 2.8 * 10 ^-5 * mol / L する。
この動画を見る
2025 北海道大学
log2= 0.3 * log3= 0.48 * log7 = 0.85
0.14mol/Lの酢酸水溶液15mLを0.070mol/Lの水酸化ナトリウム水溶液で滴定した。滴下開始直後はpHの変化がやや大きくなった。その後、中和点付近までは滴下量を増やしてもpHの変化は小さかった。これは、酢酸と酢酸ナトリウムの両方が含まれた水溶液にOH-を少量滴下しても、水溶液中のOH-の濃度はほとんど増加しないためである。このような溶液を[ 」という。酢酸に対して十分な量の 「酢酸ナトリウムが含まれている場合には、酢酸イオン濃度が高いため、酢酸はほとんど電離していないと考えることができる。
(1) 下線部(i)について、完全に中和するために必要な水酸化ナトリウム水溶液の体積(mL)を有効数字2桁で答えよ。
(2) 下線部(ii)を表す適切な反応式をOH-を用いて答えよ。
(3)空欄[]にあてはまる適切な語句を答えよ。
(4) 水酸化ナトリウム水溶液を20mL滴下したときの混合水溶液のpHを計算し、 小数第一位まで答えよ。酢酸の電離定数は 2.8 * 10 ^-5 * mol / L する。
高校化学 入試直前チェック 化学平衡 アルゴンを入れると平衡はどちらに移動するか問題

単元:
#化学#化学平衡と平衡移動
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
$N_2 + 3H_2 ⇄ 2NH_3$
上の平衡反応において温度一定で次のように条件を変える。平衡は移動するか?
①体積一定で$Ar$を加えたとき
②全圧一定で$Ar$を加えたとき
この動画を見る
$N_2 + 3H_2 ⇄ 2NH_3$
上の平衡反応において温度一定で次のように条件を変える。平衡は移動するか?
①体積一定で$Ar$を加えたとき
②全圧一定で$Ar$を加えたとき
理論化学基礎演習21 溶解度積の計算

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
2024 金沢医科大学(医)
室温において、1 * 10 ^ - 5 * mol / Lの硝酸銀 AgNO3 水溶液30mLに、ある濃度の塩化ナトリウム水溶液を加えていくと、20mLを超えた時点で塩化銀 AgClの沈殿が生じ始めた。NaCl 水溶液のモル濃度は何mol/Lか。ただし、室温での AgCl の溶解度積 Kspは 1.8 * 10 ^ - 10 * (mol / L) ^ 2 とする。
この動画を見る
2024 金沢医科大学(医)
室温において、1 * 10 ^ - 5 * mol / Lの硝酸銀 AgNO3 水溶液30mLに、ある濃度の塩化ナトリウム水溶液を加えていくと、20mLを超えた時点で塩化銀 AgClの沈殿が生じ始めた。NaCl 水溶液のモル濃度は何mol/Lか。ただし、室温での AgCl の溶解度積 Kspは 1.8 * 10 ^ - 10 * (mol / L) ^ 2 とする。
【旧センター試験化学】2019追試 第2問 問5 緩衝液ができる条件

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問5
2種類の水溶液を同体積ずつ混合したとき,緩衝液が得られる水溶液の組合
せとして最も適当なものを,次の①~⑤のうちから一つ選べ。
①0.10 mol/Lの塩酸と0.10mol/Lのアンモニア水
②0.10 mol/Lの塩酸と0.20mol/Lのアンモニア水
③0.10 mol/Lの塩酸と0.10 mol/Lの水酸化ナトリウム水溶液
④0.10 mol/Lの硫酸水溶液と0.20mol/Lのアンモニア水
⑤0.10 mol/Lの硫酸水溶液と0.20mol/Lの水酸化ナトリウム水溶液
この動画を見る
問5
2種類の水溶液を同体積ずつ混合したとき,緩衝液が得られる水溶液の組合
せとして最も適当なものを,次の①~⑤のうちから一つ選べ。
①0.10 mol/Lの塩酸と0.10mol/Lのアンモニア水
②0.10 mol/Lの塩酸と0.20mol/Lのアンモニア水
③0.10 mol/Lの塩酸と0.10 mol/Lの水酸化ナトリウム水溶液
④0.10 mol/Lの硫酸水溶液と0.20mol/Lのアンモニア水
⑤0.10 mol/Lの硫酸水溶液と0.20mol/Lの水酸化ナトリウム水溶液
理論化学基礎演習20 四酸化二窒素と二酸化窒素の平衡反応

単元:
#化学#化学理論#無機#化学平衡と平衡移動#非金属元素の単体と化合物#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
容積を変えることができる密閉容器に四酸化二窒素を封入してしばらく放置しておくと、
四酸化二窒素の一部は二酸化窒素に変化し、平衡状態に達する。
NO ⇄2NO₂放置したところ、新たな平衡状態に達した。このとき、容器内に存在する二酸化窒素は何molか、有効数字3桁で求めよ。
※必要ならば、用いること。 sqrt 2 =1.41. sqrt(3) = 1.73 , sqrt 7 =2.64, sqrt 13 =3.61 xi
この動画を見る
容積を変えることができる密閉容器に四酸化二窒素を封入してしばらく放置しておくと、
四酸化二窒素の一部は二酸化窒素に変化し、平衡状態に達する。
NO ⇄2NO₂放置したところ、新たな平衡状態に達した。このとき、容器内に存在する二酸化窒素は何molか、有効数字3桁で求めよ。
※必要ならば、用いること。 sqrt 2 =1.41. sqrt(3) = 1.73 , sqrt 7 =2.64, sqrt 13 =3.61 xi
2018追試 第2問 問5 水酸化マグネシウムの溶解度積
2018追試 第2問 問4 水素イオン・水酸化物イオンの濃度
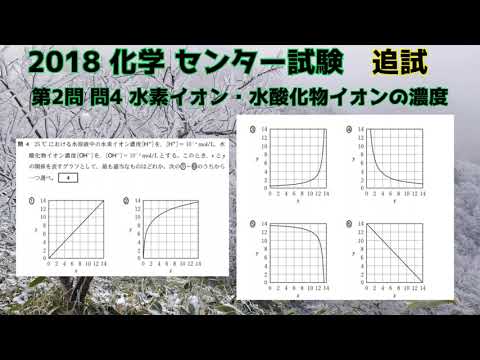
2018追試 第2問 問3 平衡の移動 移動の考え方も説明します

2024追試第2問 問3 硫酸バリウムの溶解平衡

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
室温における硫酸バリウム $BaSO_4$(式量233)飽和水溶液の濃度は $1 \times 10^{-5}mol/L$である。
$900ml$の水に$10.4mg$の塩化バリウム$BaCl_2$ (式量 208)が溶けている溶液に、$100ml$の水に$142mg$の硫酸ナトリウム $Na_2SO_4$(式量142)が溶けている溶液を加えてよく撹拌した。
このとき、沈殿せずに水溶液中に存在しているバリウムイオン$Ba^{2+}$の濃度は何$mol/L$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、$BaSO_4$、沈殿の生成に伴う硫酸イオン $SO_4^{2-}$濃度の減少や、混合による溶液の体積変化は無視できるものとする。
①$0$
②$1 \times 10^{-7}$
③$5 \times 10^{-7}$
④$1 \times 10^{-6}$
⑤$5 \times 10^{-6}$
⑥$1 \times 10^{-5}$
この動画を見る
室温における硫酸バリウム $BaSO_4$(式量233)飽和水溶液の濃度は $1 \times 10^{-5}mol/L$である。
$900ml$の水に$10.4mg$の塩化バリウム$BaCl_2$ (式量 208)が溶けている溶液に、$100ml$の水に$142mg$の硫酸ナトリウム $Na_2SO_4$(式量142)が溶けている溶液を加えてよく撹拌した。
このとき、沈殿せずに水溶液中に存在しているバリウムイオン$Ba^{2+}$の濃度は何$mol/L$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、$BaSO_4$、沈殿の生成に伴う硫酸イオン $SO_4^{2-}$濃度の減少や、混合による溶液の体積変化は無視できるものとする。
①$0$
②$1 \times 10^{-7}$
③$5 \times 10^{-7}$
④$1 \times 10^{-6}$
⑤$5 \times 10^{-6}$
⑥$1 \times 10^{-5}$
2024追試第2問 問2 化学反応の係数比

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
気体$X$と気体$Y$から気体$Z$が生成する反応は可逆反応であり、次の式(3)で 表される。
$X+bY⇄cZ$
密閉容器に$X$と$Y$を$1.0mol$ずつ入れて温度を一定に保ったところ、平衡状態での$X、Y、Z$の物質量はそれぞれ$0.60 mol$ $0,80 mol.$ $0.40 mol$となった。
係数$a$と$b$の比$\displaystyle \frac{a}{b}$として最も適当な数値を、次の①~⑦のうちから一つ選べ。
①$0.50$
②$0.67$
③$0.75$
④$1.0$
⑤$1.3$
⑥$1.5$
⑦$2.0$
この動画を見る
気体$X$と気体$Y$から気体$Z$が生成する反応は可逆反応であり、次の式(3)で 表される。
$X+bY⇄cZ$
密閉容器に$X$と$Y$を$1.0mol$ずつ入れて温度を一定に保ったところ、平衡状態での$X、Y、Z$の物質量はそれぞれ$0.60 mol$ $0,80 mol.$ $0.40 mol$となった。
係数$a$と$b$の比$\displaystyle \frac{a}{b}$として最も適当な数値を、次の①~⑦のうちから一つ選べ。
①$0.50$
②$0.67$
③$0.75$
④$1.0$
⑤$1.3$
⑥$1.5$
⑦$2.0$
1分で解いてほしい化学計算問題 (59) 生成エンタルピー

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[定番問題]
水(液)、二酸化炭素(気)の生成エンタルピーは、それぞれ
$-286kJ/mol,-394kJ/mol$であり、メタノール(液)の燃焼エンタルピーが$-726kJ/mol$であるとき、メタノール(液)の生成エンタルピーの値$〔kJ/mol〕$を整数で求めよ。
この動画を見る
[定番問題]
水(液)、二酸化炭素(気)の生成エンタルピーは、それぞれ
$-286kJ/mol,-394kJ/mol$であり、メタノール(液)の燃焼エンタルピーが$-726kJ/mol$であるとき、メタノール(液)の生成エンタルピーの値$〔kJ/mol〕$を整数で求めよ。
1分で解いてほしい化学計算問題 (55) 純水の電離度

単元:
#化学#化学基礎2ー物質の変化#化学理論#酸と塩基・水素イオン濃度#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[2023年 金沢医科大学]
常温$(25\,{\rm{℃}})$における純水の電離度を求めなさい。
(水の分子$18$、密度$1.0\,\rm{g/cm^3}$、
水のイオン積$[\ce{H}^+][\ce{OH}^-]=1.0\times 10^{-14}\rm{(mol/L)}^2 )$
この動画を見る
[2023年 金沢医科大学]
常温$(25\,{\rm{℃}})$における純水の電離度を求めなさい。
(水の分子$18$、密度$1.0\,\rm{g/cm^3}$、
水のイオン積$[\ce{H}^+][\ce{OH}^-]=1.0\times 10^{-14}\rm{(mol/L)}^2 )$
グラフ問題15 電離定数とpHの関係

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電離平衡の状態にある弱酸$HA$の水溶液では、$HA$の電離度は$1$より十分小さく、また水素イオンのモル濃度 $[H^+]$と$HA$から電離して生じた$A^-$のモル濃度$[A^-]$は等しいと考えることができる。
$HA$の電離定数$K$を
$K_a=\displaystyle \frac{[H^+][A^-]}{[HA]}=10^{-x}mol/L$
と表すとき、$0.10mol/L$の$HA$水溶液について、と$pH$の関係を示すグラフとして最も適当なものを、次ページの①~⑥のうちから一つ選べ。
※グラフは動画内参照
この動画を見る
電離平衡の状態にある弱酸$HA$の水溶液では、$HA$の電離度は$1$より十分小さく、また水素イオンのモル濃度 $[H^+]$と$HA$から電離して生じた$A^-$のモル濃度$[A^-]$は等しいと考えることができる。
$HA$の電離定数$K$を
$K_a=\displaystyle \frac{[H^+][A^-]}{[HA]}=10^{-x}mol/L$
と表すとき、$0.10mol/L$の$HA$水溶液について、と$pH$の関係を示すグラフとして最も適当なものを、次ページの①~⑥のうちから一つ選べ。
※グラフは動画内参照
1分で解いてほしい化学計算問題 (53) 弱酸の電離定数

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[2023年 川崎医療福祉大学]
ある1価の弱酸の$0.10mol/L$水溶液の電離度が$0.0050$であったとき、
この弱酸の電離定数は何$mol/L$か。
最も適当なものを、次の$a~e$のうちから一つ選べ。
電離度は$1$に比べて非常に小さいものとしてよい。
$a 2.5x10-7mol/L$
$b 2.5×10-6mol/L$
$c 5.0×10-4mol/L$
$d 2.5x10-3mol/L $
$e 5.0x10-2mol/L$
この動画を見る
[2023年 川崎医療福祉大学]
ある1価の弱酸の$0.10mol/L$水溶液の電離度が$0.0050$であったとき、
この弱酸の電離定数は何$mol/L$か。
最も適当なものを、次の$a~e$のうちから一つ選べ。
電離度は$1$に比べて非常に小さいものとしてよい。
$a 2.5x10-7mol/L$
$b 2.5×10-6mol/L$
$c 5.0×10-4mol/L$
$d 2.5x10-3mol/L $
$e 5.0x10-2mol/L$
グラフ問題12 中和と電気伝導率の変化

単元:
#化学#化学基礎2ー物質の変化#化学理論#化学平衡と平衡移動#中和と塩#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ビーカーに$0.100mol/L$の塩酸を$10.00mL$入れ、
ここに電極間の距離が固定されている2本の白金電極を浸して、それらの電極からの導線を電流計と定電圧電源に接続した(図1)。
この状態で定電圧電源のスイッチを入れ、電流値を測定した。
次にこの塩酸の入ったビーカーに$0.100mol/L$の水酸化ナトリウム水溶液を滴下しながら、その都度一定の電圧をかけ、その時の電流 値を記録した。
この操作を水酸化ナトリウム水溶液の滴下量が $20.0mL$になるまで行った。
通電は電流値の測定時にだけ極めて 短時間行うものとし、
いずれの電極においても水の電気分解や 気体の発生などの
酸化還元反応、液温の変化などは無視できるものとする。
また全てのイオンにおいて、電流値への寄与は等 しいものとする。
実験結果を、横軸を水酸化ナトリウム水溶液の滴下量$〔mL〕$、縦軸を電流$ 〔A〕 $としたグラフで表すと
どのようになるか。
最も適切なグラフを図2の$A~F$から一つ選べ。
ただし、これらの全てのグラフでは目盛りは同一である。
($0.100mol/L$の塩酸$10.00mL$に$0.100mol/L$
の水酸化ナトリウム水溶液を加えている)
※図・グラフは動画内参照
この動画を見る
ビーカーに$0.100mol/L$の塩酸を$10.00mL$入れ、
ここに電極間の距離が固定されている2本の白金電極を浸して、それらの電極からの導線を電流計と定電圧電源に接続した(図1)。
この状態で定電圧電源のスイッチを入れ、電流値を測定した。
次にこの塩酸の入ったビーカーに$0.100mol/L$の水酸化ナトリウム水溶液を滴下しながら、その都度一定の電圧をかけ、その時の電流 値を記録した。
この操作を水酸化ナトリウム水溶液の滴下量が $20.0mL$になるまで行った。
通電は電流値の測定時にだけ極めて 短時間行うものとし、
いずれの電極においても水の電気分解や 気体の発生などの
酸化還元反応、液温の変化などは無視できるものとする。
また全てのイオンにおいて、電流値への寄与は等 しいものとする。
実験結果を、横軸を水酸化ナトリウム水溶液の滴下量$〔mL〕$、縦軸を電流$ 〔A〕 $としたグラフで表すと
どのようになるか。
最も適切なグラフを図2の$A~F$から一つ選べ。
ただし、これらの全てのグラフでは目盛りは同一である。
($0.100mol/L$の塩酸$10.00mL$に$0.100mol/L$
の水酸化ナトリウム水溶液を加えている)
※図・グラフは動画内参照
グラフ問題11 酢酸と酢酸イオンの存在比から電離定数を求める!

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図は、酢酸の水溶液中における酢酸分子と酢酸イオンについて、それぞれのモル濃度$[CH_3COOH]$および $[CH_3COO^-]$
の割合と水溶液の$pH$との関係を示したものである。
グラフから数値を読み取り、電離定数Kaを有効数字2桁で求めよ。$10^{0.3} = 2.00$
※図・グラフは動画内参照
この動画を見る
図は、酢酸の水溶液中における酢酸分子と酢酸イオンについて、それぞれのモル濃度$[CH_3COOH]$および $[CH_3COO^-]$
の割合と水溶液の$pH$との関係を示したものである。
グラフから数値を読み取り、電離定数Kaを有効数字2桁で求めよ。$10^{0.3} = 2.00$
※図・グラフは動画内参照
グラフ問題7 化学平衡の問題 圧力と温度の変化に伴う生成物の量の変化を表そう!

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
一酸化炭素と水素からメタノールが生成する化学反応式は、次の式で示される。
$CO$(気)$+2H_2$(気) → $CH_3OH$(気) $△H=-105kJ$
この可逆反応が密閉状態で平衡状態にあるとき、
生成物の割合(体積$%$)と圧力、温度の関係を示したグラフとして適切なものを、下の$A~F$のうちから1つ選べ。
ただし、グラフ中のTは 温度を表し、$T_1<T_2$とする。
※グラフは動画内参照
この動画を見る
一酸化炭素と水素からメタノールが生成する化学反応式は、次の式で示される。
$CO$(気)$+2H_2$(気) → $CH_3OH$(気) $△H=-105kJ$
この可逆反応が密閉状態で平衡状態にあるとき、
生成物の割合(体積$%$)と圧力、温度の関係を示したグラフとして適切なものを、下の$A~F$のうちから1つ選べ。
ただし、グラフ中のTは 温度を表し、$T_1<T_2$とする。
※グラフは動画内参照
共通テスト(旧センター試験)過去問解説 化学 2017年追試 第2問 問3 化学平衡の法則

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
$1mol$の気体$X_2$と$2mol$の気体$Y_2$を、
容積が変化しない密閉容器に入れて一定温度に保ったところ、
次式のような可逆反応により気体$XY$が生成し、平衡状態に達した。
このときの平衡定数を$K$とする。
$X_2+Y_2⇄XY$
この平衡状態に関する次の記述$(a~c)$について、
正誤の組合せとして正しいものを、
下の①~⑧のうちから一つ選べ。
$a: \displaystyle \frac{2[XY]}{[X_2][Y_2]}=K$が成り立つ。
$b: X_2$の物質量がわかれば、$K$を求めることができる。
$c:$ 密閉容器中の気体の物質量の総和は$3mol$である。
この動画を見る
$1mol$の気体$X_2$と$2mol$の気体$Y_2$を、
容積が変化しない密閉容器に入れて一定温度に保ったところ、
次式のような可逆反応により気体$XY$が生成し、平衡状態に達した。
このときの平衡定数を$K$とする。
$X_2+Y_2⇄XY$
この平衡状態に関する次の記述$(a~c)$について、
正誤の組合せとして正しいものを、
下の①~⑧のうちから一つ選べ。
$a: \displaystyle \frac{2[XY]}{[X_2][Y_2]}=K$が成り立つ。
$b: X_2$の物質量がわかれば、$K$を求めることができる。
$c:$ 密閉容器中の気体の物質量の総和は$3mol$である。
グラフ問題4 温度変化によってSO₃の生成量はどう変わるか?

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
$2SO_2(気) + O_2(気)⇄2SO_3(気) ∆H = -160kJ$
左の図は、二酸化硫黄と酸素を反応容器に入れて、
$T、〔K〕$に保って反応させたときの反応時間と
$SO_3$の生成量とを表すグラフである。
他の反応条件は変化させずに、温度だけを$T_1$より
低温である$T_2〔K〕$に保って、二酸化硫黄と酸素を反応容器に入れて反応させたとき、反応時間と$SO_3$の生成量を表すグラフとして最も適当なものを選べ
(変わらない場合は⑥を選べ)。
※グラフは動画内参照
この動画を見る
$2SO_2(気) + O_2(気)⇄2SO_3(気) ∆H = -160kJ$
左の図は、二酸化硫黄と酸素を反応容器に入れて、
$T、〔K〕$に保って反応させたときの反応時間と
$SO_3$の生成量とを表すグラフである。
他の反応条件は変化させずに、温度だけを$T_1$より
低温である$T_2〔K〕$に保って、二酸化硫黄と酸素を反応容器に入れて反応させたとき、反応時間と$SO_3$の生成量を表すグラフとして最も適当なものを選べ
(変わらない場合は⑥を選べ)。
※グラフは動画内参照
【京都薬科大学(薬)】令和5年度一般選抜試験(B方式)硫酸銅(Ⅱ)五水和物の析出量問題

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
原子量$H 1 O 16 S 32 Cu 64$
$20℃$での$CuSO_4$の溶解度:水$100g$に対して$20g$
水に不溶の固体区が混入した$CuSO_4・5H_2O$の結晶が$80g$ある。
この結晶を$80℃$で水$71g$に溶かしてろ過すると、ろ紙には$ⓧ$のみが$5g$残った。
ろ液を$80℃$から$20℃$まで冷却したところ、
純粋な$CuSO_4・5H_2O$の結晶が析出した。
析出した$CuSO_4・5H_2O$の結晶は最大何$g$か。
答えは四捨五入して整数値で記せ。
ただし、$ⓧ$はろ紙を通過しないものとし、
すべての操作の過程で$ⓧ$、 $CuSO_4$,
水の損失は無いものとする。
この動画を見る
原子量$H 1 O 16 S 32 Cu 64$
$20℃$での$CuSO_4$の溶解度:水$100g$に対して$20g$
水に不溶の固体区が混入した$CuSO_4・5H_2O$の結晶が$80g$ある。
この結晶を$80℃$で水$71g$に溶かしてろ過すると、ろ紙には$ⓧ$のみが$5g$残った。
ろ液を$80℃$から$20℃$まで冷却したところ、
純粋な$CuSO_4・5H_2O$の結晶が析出した。
析出した$CuSO_4・5H_2O$の結晶は最大何$g$か。
答えは四捨五入して整数値で記せ。
ただし、$ⓧ$はろ紙を通過しないものとし、
すべての操作の過程で$ⓧ$、 $CuSO_4$,
水の損失は無いものとする。
【この一本で全部確認!!】化学平衡まとめ(化学平衡の基礎・圧平衡・ルシャトリエの原理・電離平衡・pH・溶解度積・緩衝液・モール法)〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
化学平衡についてまとめました。
・化学平衡の基礎
・圧平衡
・ルシャトリエの原理
・電離平衡
・pH
・溶解度積
・緩衝液
・モール法
この動画を見る
化学平衡についてまとめました。
・化学平衡の基礎
・圧平衡
・ルシャトリエの原理
・電離平衡
・pH
・溶解度積
・緩衝液
・モール法
【この一本でバッチリ!!】電離平衡〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
電離平衡について解説します。
Q.$25$℃での$0.27$mol/L酢酸水溶液の電離度とpHを求めよ。
ただし、酢酸の電離定数は$2.7×10^{-5} $mol/Lとする。$log_{10}2.7=0.43$
この動画を見る
電離平衡について解説します。
Q.$25$℃での$0.27$mol/L酢酸水溶液の電離度とpHを求めよ。
ただし、酢酸の電離定数は$2.7×10^{-5} $mol/Lとする。$log_{10}2.7=0.43$
【この一本でバッチリ!!】圧平衡定数の求め方〔現役講師解説、高校化学、化学基礎、2023年度版〕

【この一本でバッチリ!!】化学平衡の基礎〔現役講師解説、高校化学、化学基礎、2023年度版〕

共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問3 平衡定数の計算(基礎)

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
$1.0mol$の気体$A$のみが入った密閉容器に$1.0mol$の気体$B$を加えたところ、気体$C$および$D$が生成して、次式の平衛が成立した。
$A+B⇄C+D$
このときの$C$の物質として最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、容器内の温度と体積は一定とし、子の温度における反応平衛定数は$0.25$とする。
①$0.25$ ②$0.33$ ③$0.50$ ④$0.67$ ⑤$0.75$
この動画を見る
$1.0mol$の気体$A$のみが入った密閉容器に$1.0mol$の気体$B$を加えたところ、気体$C$および$D$が生成して、次式の平衛が成立した。
$A+B⇄C+D$
このときの$C$の物質として最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、容器内の温度と体積は一定とし、子の温度における反応平衛定数は$0.25$とする。
①$0.25$ ②$0.33$ ③$0.50$ ④$0.67$ ⑤$0.75$
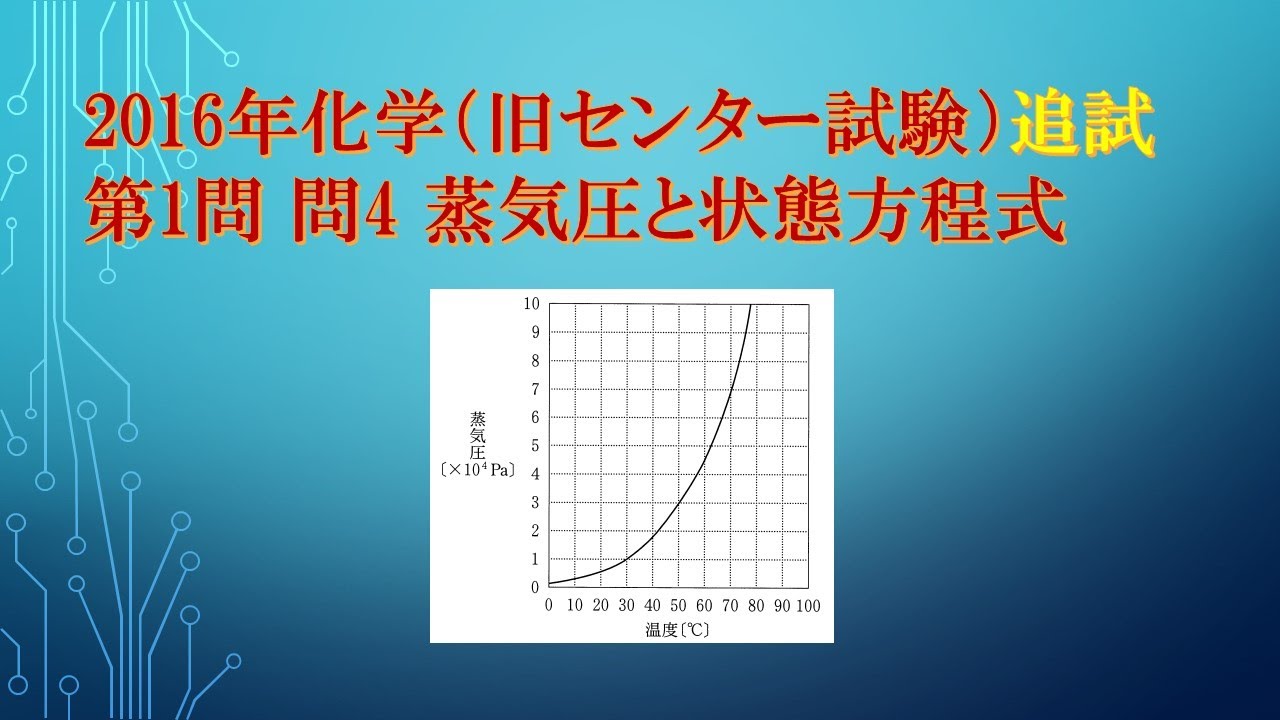
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第1問 問4 蒸気圧と状態方程式
単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図2はエタノールの蒸気圧曲線である。
容積 $1.0L$の密閉容器に $0.010 mol$ のエタノールのみが入っている。
容器の温度が$40℃$および$60℃$のとき、容器内の圧力はそれぞれ何か、圧力の値の組合せとして最も適当なものを、下の①~⑦のうちから一つ選べ。
ただし、気体定数は $R = 8.3 × 10^2 Pa-L/(K・mol)$とする。
また、容器内での液体の体積は無視できるものとする。
※表・図は動画内参照
この動画を見る
図2はエタノールの蒸気圧曲線である。
容積 $1.0L$の密閉容器に $0.010 mol$ のエタノールのみが入っている。
容器の温度が$40℃$および$60℃$のとき、容器内の圧力はそれぞれ何か、圧力の値の組合せとして最も適当なものを、下の①~⑦のうちから一つ選べ。
ただし、気体定数は $R = 8.3 × 10^2 Pa-L/(K・mol)$とする。
また、容器内での液体の体積は無視できるものとする。
※表・図は動画内参照
1分で解いてほしい化学計算問題 (12) 圧平衡定数

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
〔2023 京都産業大学(改)〕
密閉容器中、温度$1000K$で、次の反応が平衛状態となっている。
$CO_2$(気)$+C$(固)$⇄2CO$(気)
全圧は$1.0 \times 10^5Pa,CO$の体積百分率は$80%$であった。
このときの圧平衛定数を単位をつけて有効数字2桁で求めよ。
この動画を見る
〔2023 京都産業大学(改)〕
密閉容器中、温度$1000K$で、次の反応が平衛状態となっている。
$CO_2$(気)$+C$(固)$⇄2CO$(気)
全圧は$1.0 \times 10^5Pa,CO$の体積百分率は$80%$であった。
このときの圧平衛定数を単位をつけて有効数字2桁で求めよ。
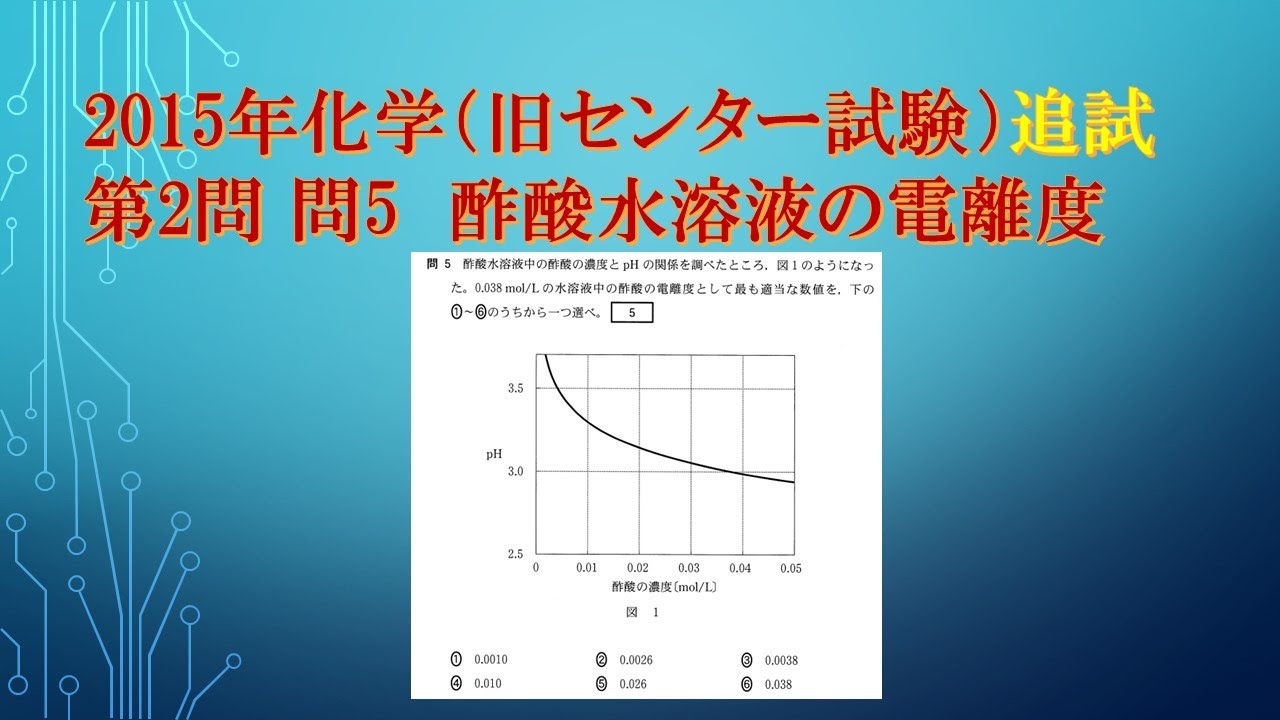
共通テスト(旧センター試験)過去問解説 化学 2015年追試 第2問 問5 酢酸水溶液の電離度
単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
酢酸水溶液中の酢酸の濃度と$pH$の関係を調べたところ、図1のようになっ た。
$0.038 mol/L$の水溶液中の酢酸の電離度として最も適当な数値を、
下の ①~⑥のうちから一つ選べ。
①$0.0010$ ②$0.0026$ ③$0.0038$
④$0.010$ ⑤$0.026$ ⑥$0.038$
※図は動画内参照
この動画を見る
酢酸水溶液中の酢酸の濃度と$pH$の関係を調べたところ、図1のようになっ た。
$0.038 mol/L$の水溶液中の酢酸の電離度として最も適当な数値を、
下の ①~⑥のうちから一つ選べ。
①$0.0010$ ②$0.0026$ ③$0.0038$
④$0.010$ ⑤$0.026$ ⑥$0.038$
※図は動画内参照
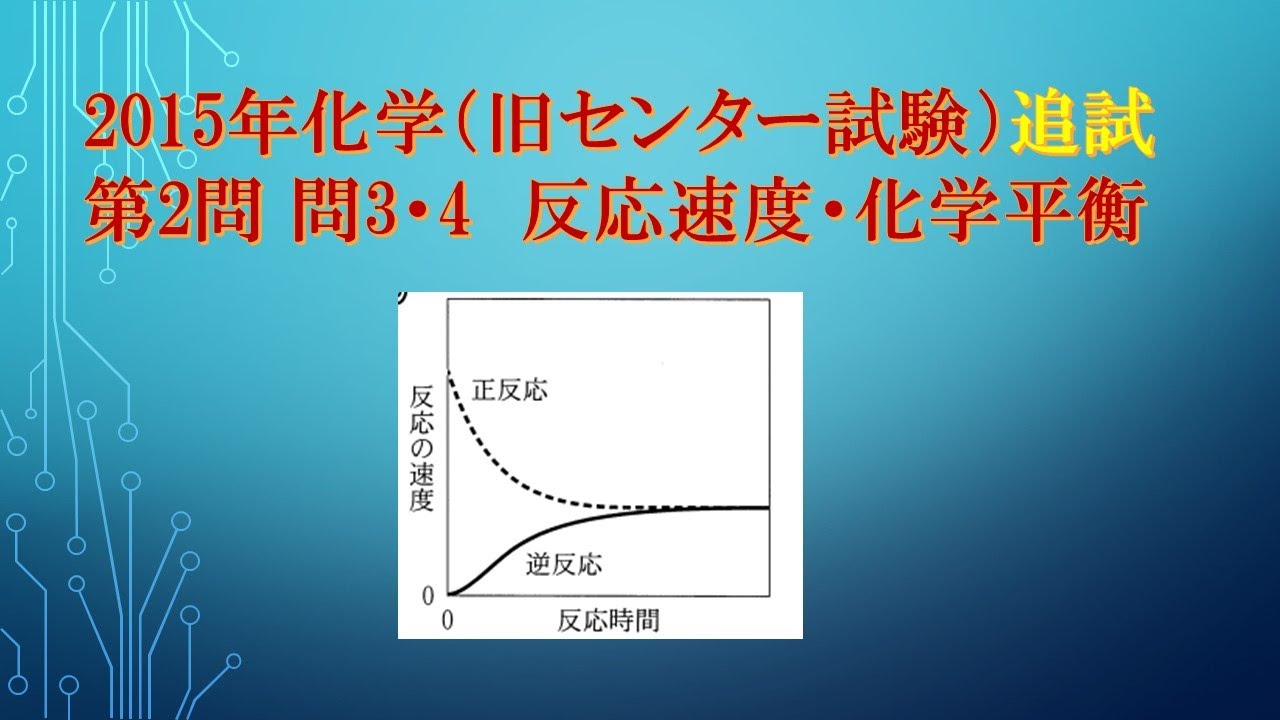
共通テスト(旧センター試験)過去問解説 化学 2015年追試 第2問 問3・4 反応速度・化学平衡
単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
一定温度,一定体積の密閉容器内で、$H_2$(気)と$I_2$(気)を混合したところ、 $HI$ (気)が生成して平衡状態に達した。
混合してから平衡状態に達するまでの 正反応(破線)と逆反応(実線)の速度の変化として最も適当なものを、次の①~ ⑥のうちから一つ選べ。
ただし、正反応の速度の変化(破線)はすべての選択肢で同じである。
※図は動画内参照
平衡反応における触媒の作用に関する一般的記述として誤りを含むものを、 次の①~⑤のうちから一つ選べ。
① 触媒を加えても、正反応の反応速度は変化しない。
② 触媒を加えても、反応熱は変化しない。
③ 触媒を加えると、正反応の活性化エネルギーは小さくなる。
④ 触媒を加えると、逆反応の活性化エネルギーは小さくなる。
⑤ 反応が平衡に達したのちに触媒を加えても、平衡は移動しない。
この動画を見る
一定温度,一定体積の密閉容器内で、$H_2$(気)と$I_2$(気)を混合したところ、 $HI$ (気)が生成して平衡状態に達した。
混合してから平衡状態に達するまでの 正反応(破線)と逆反応(実線)の速度の変化として最も適当なものを、次の①~ ⑥のうちから一つ選べ。
ただし、正反応の速度の変化(破線)はすべての選択肢で同じである。
※図は動画内参照
平衡反応における触媒の作用に関する一般的記述として誤りを含むものを、 次の①~⑤のうちから一つ選べ。
① 触媒を加えても、正反応の反応速度は変化しない。
② 触媒を加えても、反応熱は変化しない。
③ 触媒を加えると、正反応の活性化エネルギーは小さくなる。
④ 触媒を加えると、逆反応の活性化エネルギーは小さくなる。
⑤ 反応が平衡に達したのちに触媒を加えても、平衡は移動しない。
共通テスト(旧センター試験)過去問解説 化学 2015年 第2問 問3

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
表1に示す濃度の硝酸銀水溶液$100mL$と塩化ナトリウム水溶液$100mL$を混合する実験Ⅰ~Ⅲを行った。
実験Ⅰ~Ⅲでの沈殿生成の有無の組み合わせとして、
最も適当なものを、下の①~⑧のうちから一つ選べ。
ただし、塩化銀の溶解度積を、$1.8 × 10^{-10}(mol/L)^2$とする。
※表は動画内参照
この動画を見る
表1に示す濃度の硝酸銀水溶液$100mL$と塩化ナトリウム水溶液$100mL$を混合する実験Ⅰ~Ⅲを行った。
実験Ⅰ~Ⅲでの沈殿生成の有無の組み合わせとして、
最も適当なものを、下の①~⑧のうちから一つ選べ。
ただし、塩化銀の溶解度積を、$1.8 × 10^{-10}(mol/L)^2$とする。
※表は動画内参照
