 大学入試過去問(化学)
大学入試過去問(化学)
 大学入試過去問(化学)
大学入試過去問(化学)
共通テストを終えて_全部難しかったよ

単元:
#大学入試過去問(数学)#物理#化学#生物#情報Ⅰ(高校生)#センター試験・共通テスト関連#共通テスト#大学入試過去問(物理)#大学入試過去問(化学)#英語(高校生)#国語(高校生)#社会(高校生)#日本史#世界史#大学入試過去問(英語)#大学入試過去問(国語)#共通テスト#共通テスト(現代文)#大学入試過去問(生物)#共通テスト・センター試験#共通テスト(古文)#共通テスト#大学入試過去問・共通テスト・模試関連#大学入試過去問・共通テスト・模試関連#数学(高校生)#理科(高校生)#共通テスト#模試解説・過去問解説#【河合塾】全統共通テスト模試
指導講師:
カサニマロ【べんとう・ふきのとうの授業動画】
この動画を見る
共通テスト2日目_ふきふき占い【午後も頑張れ】

単元:
#大学入試過去問(数学)#物理#化学#生物#情報Ⅰ(高校生)#センター試験・共通テスト関連#共通テスト#大学入試過去問(物理)#大学入試過去問(化学)#英語(高校生)#国語(高校生)#社会(高校生)#日本史#世界史#大学入試過去問(英語)#大学入試過去問(国語)#共通テスト#共通テスト(現代文)#大学入試過去問(生物)#共通テスト・センター試験#共通テスト(古文)#共通テスト#大学入試過去問・共通テスト・模試関連#大学入試過去問・共通テスト・模試関連#数学(高校生)#理科(高校生)#共通テスト#模試解説・過去問解説#【河合塾】全統共通テスト模試
指導講師:
カサニマロ【べんとう・ふきのとうの授業動画】
この動画を見る
【旧センター試験化学】2020追試 第4問 問5 アゾ化合物の合成

単元:
#化学#大学入試過去問(化学)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
間5 アニリンを用いる次の実験Ⅰ~Ⅲについて、下の問い(a・b)に答えよ。
実験Ⅰ 三角フラスコにアニリンと希塩酸を入れて酸性の水溶液とし、これを氷冷した。このフラスコに氷冷した亜硝酸ナトリウム水溶液を加えると、化合物が生成した。この化合物Aを含む溶液を水溶液×とする。
実験Ⅱ 試験管にフェノールを入れ、水酸化ナトリウム水溶液を加えて溶かし、これを水冷した。この溶液を水溶液とする。
実験Ⅲ 水冷した水溶液Xに水溶液Yを加えると、橙色の化合物Bが生成した。
a 水溶液を水冷せずに室温で放置すると、化合物Aが分解し、気体Cと化合物Dが生じる。気体Cと化合物Dの組合せとして最も適当なものを。 次の①~⑤のうちから一つ選べ。
① 気体C:窒素,化合物D:ベンゼン環-CI
② 気体C:窒素,化合物D:ベンゼン環-OH
③ 気体C:窒素,化合物D:ベンゼン
④ 気体C:二酸化窒素,化合物D:ベンゼン環-CI
⑤ 気体C:二酸化窒素,化合物D:ベンゼン環-OH
⑥ 気体C:二酸化窒素,化合物D:ベンゼン
b 実験Ⅲに関する次の文章中のア~ウに当てはまる語の組合せとして最も適当なものを、下の①~⑧のうちから一つ選べ。 6
化合物Bが生成する反応では、新たにア 原子と イ 原子の間に結合が形成される。また、化合物Bはウ を有する。
① ア,炭素 イ,炭素 ウ,アミド結合
② ア,炭素 イ,窒素 ウ,アミド結合
③ ア,炭素 イ,酸素 ウ,アミド結合
④ ア,窒素 イ,窒素 ウ,アミド結合
⑤ ア,炭素 イ,炭素 ウ,アゾ基
⑤ ア,炭素 イ,窒素 ウ,アゾ基
⑥ ア,炭素 イ,酸素 ウ,アゾ基
⑦ ア,窒素 イ,窒素 ウ,アゾ基
この動画を見る
間5 アニリンを用いる次の実験Ⅰ~Ⅲについて、下の問い(a・b)に答えよ。
実験Ⅰ 三角フラスコにアニリンと希塩酸を入れて酸性の水溶液とし、これを氷冷した。このフラスコに氷冷した亜硝酸ナトリウム水溶液を加えると、化合物が生成した。この化合物Aを含む溶液を水溶液×とする。
実験Ⅱ 試験管にフェノールを入れ、水酸化ナトリウム水溶液を加えて溶かし、これを水冷した。この溶液を水溶液とする。
実験Ⅲ 水冷した水溶液Xに水溶液Yを加えると、橙色の化合物Bが生成した。
a 水溶液を水冷せずに室温で放置すると、化合物Aが分解し、気体Cと化合物Dが生じる。気体Cと化合物Dの組合せとして最も適当なものを。 次の①~⑤のうちから一つ選べ。
① 気体C:窒素,化合物D:ベンゼン環-CI
② 気体C:窒素,化合物D:ベンゼン環-OH
③ 気体C:窒素,化合物D:ベンゼン
④ 気体C:二酸化窒素,化合物D:ベンゼン環-CI
⑤ 気体C:二酸化窒素,化合物D:ベンゼン環-OH
⑥ 気体C:二酸化窒素,化合物D:ベンゼン
b 実験Ⅲに関する次の文章中のア~ウに当てはまる語の組合せとして最も適当なものを、下の①~⑧のうちから一つ選べ。 6
化合物Bが生成する反応では、新たにア 原子と イ 原子の間に結合が形成される。また、化合物Bはウ を有する。
① ア,炭素 イ,炭素 ウ,アミド結合
② ア,炭素 イ,窒素 ウ,アミド結合
③ ア,炭素 イ,酸素 ウ,アミド結合
④ ア,窒素 イ,窒素 ウ,アミド結合
⑤ ア,炭素 イ,炭素 ウ,アゾ基
⑤ ア,炭素 イ,窒素 ウ,アゾ基
⑥ ア,炭素 イ,酸素 ウ,アゾ基
⑦ ア,窒素 イ,窒素 ウ,アゾ基
【旧センター試験化学】2020追試 第4問 問4 ニトロ化合物の異性体
単元:
#化学#有機#大学入試過去問(化学)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
旧センター試験2020追試 化学 第4問 問4
分子式が$C_3H_5NO_2$である化合物の異性体のうち,炭素原子間に不飽和結合をもつニトロ化合物はいくつあるか。正しい数を,次の①~⑥のうちから一つ選べ。ただし,立体異性体があれば区別して数えるものとする。
① 1 ② 2 ③ 3 ④ 4 ⑤ 5 ⑥ 6
この動画を見る
旧センター試験2020追試 化学 第4問 問4
分子式が$C_3H_5NO_2$である化合物の異性体のうち,炭素原子間に不飽和結合をもつニトロ化合物はいくつあるか。正しい数を,次の①~⑥のうちから一つ選べ。ただし,立体異性体があれば区別して数えるものとする。
① 1 ② 2 ③ 3 ④ 4 ⑤ 5 ⑥ 6
【旧センター試験化学】2020追試 第4問 問3 アセチレンの付加反応

単元:
#化学#有機#大学入試過去問(化学)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
適切な触媒を用いて,アセチレン(エチン)1分子に$H_2. H_2O. HCl. CH_3COOH$のいずれか1分子付加させたとき,炭素原子間に二重結合を含まない安定な生成物が得られるものはどれか。最も適切なものを,次の①~④のうちから一つ選べ。ただし,重合反応は起こらないものとする。
① $ H_2 $ ② $ H_2O$ ③ $ HCl $ ④ $ CH_3COOH $
この動画を見る
適切な触媒を用いて,アセチレン(エチン)1分子に$H_2. H_2O. HCl. CH_3COOH$のいずれか1分子付加させたとき,炭素原子間に二重結合を含まない安定な生成物が得られるものはどれか。最も適切なものを,次の①~④のうちから一つ選べ。ただし,重合反応は起こらないものとする。
① $ H_2 $ ② $ H_2O$ ③ $ HCl $ ④ $ CH_3COOH $
【旧センター試験化学】2020追試 第4問 問2 アルコールの酸化に関する量的関係の問題

単元:
#大学入試過去問(化学)#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
今回の問題です。原子量H1C 12O 16
問2 1-ブロバノールをクリム酸カリウムにより酸化してブロビオンアルデヒドアルデヒドC₂H₅CHOが生成する反応は,係数をaとbとして次の化学反応で表される。この反応で0.10molのニクロム酸カリウムと反応する1-ブロバノールの質量は何gか。最も適当な数値を次の1~7のうちから一つ選べ。
aC₃H₇OH+ bH₂SO₄+K₂Cr₂O₇→aC₂H₅CHO+Cr₂(SO₄)₃+K₂SO₄+7H₂O
この動画を見る
今回の問題です。原子量H1C 12O 16
問2 1-ブロバノールをクリム酸カリウムにより酸化してブロビオンアルデヒドアルデヒドC₂H₅CHOが生成する反応は,係数をaとbとして次の化学反応で表される。この反応で0.10molのニクロム酸カリウムと反応する1-ブロバノールの質量は何gか。最も適当な数値を次の1~7のうちから一つ選べ。
aC₃H₇OH+ bH₂SO₄+K₂Cr₂O₇→aC₂H₅CHO+Cr₂(SO₄)₃+K₂SO₄+7H₂O
【旧センター試験化学】2020追試 第3問 問3 溶解度積の大小関係

単元:
#化学#化学理論#大学入試過去問(化学)#溶液の性質#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
銀イオン$Ag^+$と陰イオン$X^-,Y^-$がそれぞれ水溶液中で難溶性の塩$AgX,AgY$を生成するとき,次の反応が進行すれば,$AgY$の水への溶解度積は$AgX$より小さいことがわかる。
$AgX(固) + Y^- aq \to X^- aq + AgY(固)$
このことを用いて,$AgCl,AgI,AgSCN$の溶解度積の大小関係を調べる次の実験Ⅰ~Ⅲを行った。
実験Ⅰ 2本の試験管$A,B$にそれぞれ,$Fe(NO_3)_3$の水溶液をとった。溶液の色は黄褐色であった。
実験Ⅱ 試験管$A$の水溶液に白色の$AgSCN$の固体を加えた。さらに$KI$の水溶液を加え,よく振り交ぜて静置したところ,溶液の色は赤色になり,沈殿の色は黄色であった。
実験Ⅲ 試験管$B$の水溶液に$AgCl$の固体を加えた。さらに$KSCN$の水溶液を加えたところ,溶液の色は赤くなったが,よく振り交ぜて静置したところ,溶液の色は黄褐色になり,沈殿の色は白色であった。
実験Ⅰ~Ⅲから分かる$AgCl,AgI,AgSCN$の溶解度積の大小関係として最も適当なものを,次の①~⑥のうちから一つ選べ。
① $AgCl < AgI < AgSCN$ ② $AgCl < AgI < AgSCN$
③ $AgI < AgSCN < AgCl$ ④ $AgI < AgCl < AgSCN$
⑤ $AgSCN < AgCl < AgI$ ⑥ $AgSCN < AgI < AgCl$
この動画を見る
銀イオン$Ag^+$と陰イオン$X^-,Y^-$がそれぞれ水溶液中で難溶性の塩$AgX,AgY$を生成するとき,次の反応が進行すれば,$AgY$の水への溶解度積は$AgX$より小さいことがわかる。
$AgX(固) + Y^- aq \to X^- aq + AgY(固)$
このことを用いて,$AgCl,AgI,AgSCN$の溶解度積の大小関係を調べる次の実験Ⅰ~Ⅲを行った。
実験Ⅰ 2本の試験管$A,B$にそれぞれ,$Fe(NO_3)_3$の水溶液をとった。溶液の色は黄褐色であった。
実験Ⅱ 試験管$A$の水溶液に白色の$AgSCN$の固体を加えた。さらに$KI$の水溶液を加え,よく振り交ぜて静置したところ,溶液の色は赤色になり,沈殿の色は黄色であった。
実験Ⅲ 試験管$B$の水溶液に$AgCl$の固体を加えた。さらに$KSCN$の水溶液を加えたところ,溶液の色は赤くなったが,よく振り交ぜて静置したところ,溶液の色は黄褐色になり,沈殿の色は白色であった。
実験Ⅰ~Ⅲから分かる$AgCl,AgI,AgSCN$の溶解度積の大小関係として最も適当なものを,次の①~⑥のうちから一つ選べ。
① $AgCl < AgI < AgSCN$ ② $AgCl < AgI < AgSCN$
③ $AgI < AgSCN < AgCl$ ④ $AgI < AgCl < AgSCN$
⑤ $AgSCN < AgCl < AgI$ ⑥ $AgSCN < AgI < AgCl$
【旧センター試験化学】2020追試 第3問 問2 酸化物の性質

単元:
#化学#大学入試過去問(化学)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
酸化物やオキソ酸に関する記述として下線部に誤りを含むものを,次の①~⑤のうちから一つ選べ。
① アルカリ金属元素の酸化物は, 塩基性酸化物である 。
② 非金属元素の酸化物の多くは,酸性酸化物である。
③ 酸性酸化物と水の反応によって生じる酸の多くは,オキソ酸である。
④ 同一元素のオキソ酸は,中心の原子の酸化数が大きくなり,結合している酸素原子の数が多くなるほど,弱い酸になる。
⑤ 金属元素の酸化物の中には,酸と塩基のいずれとも反応して塩をつくる両性酸化物がある。
この動画を見る
酸化物やオキソ酸に関する記述として下線部に誤りを含むものを,次の①~⑤のうちから一つ選べ。
① アルカリ金属元素の酸化物は, 塩基性酸化物である 。
② 非金属元素の酸化物の多くは,酸性酸化物である。
③ 酸性酸化物と水の反応によって生じる酸の多くは,オキソ酸である。
④ 同一元素のオキソ酸は,中心の原子の酸化数が大きくなり,結合している酸素原子の数が多くなるほど,弱い酸になる。
⑤ 金属元素の酸化物の中には,酸と塩基のいずれとも反応して塩をつくる両性酸化物がある。
【旧センター試験化学】2020追試 第3問 問1 無機物質の性質

単元:
#大学入試過去問(化学)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
身の回り無機物質に関する記述として下線部に誤りを含むものを,次の①~④のうちから一つ選べ。
①単体のヨウ素は,水に溶けやすく酸化作用を示し,殺菌消毒剤などに用いられる。
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
②塩化マグネシウムは,豆乳中のタンパク質を塩析させるので,豆腐の製造に用いられる。
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
③クロムは,空気中で表面に緻密な酸化被膜をつくるので,鉄の表面をクロムめっきすることで鉄さびを防止する
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
④単体のケイ素は,ダイヤモンドと同様に結晶構造をもち,半導体の性質を示すので,集積回路に用いられる
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
この動画を見る
身の回り無機物質に関する記述として下線部に誤りを含むものを,次の①~④のうちから一つ選べ。
①単体のヨウ素は,水に溶けやすく酸化作用を示し,殺菌消毒剤などに用いられる。
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
②塩化マグネシウムは,豆乳中のタンパク質を塩析させるので,豆腐の製造に用いられる。
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
③クロムは,空気中で表面に緻密な酸化被膜をつくるので,鉄の表面をクロムめっきすることで鉄さびを防止する
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
④単体のケイ素は,ダイヤモンドと同様に結晶構造をもち,半導体の性質を示すので,集積回路に用いられる
⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻⁻
【旧センター試験化学】2020追試 第2問 問3 水溶液の電気分解

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
Cl:35.5 Cu:64
炭素棒を電極として用い,塩化銅($Ⅱ$)水溶液の電気分解を行った。$0.50 A$の一定電流を$965$ 秒間流したとき,陰極で生じた物質の質量〔$g$〕として最も適当なものを,次の①~⑤のうちから一つ選べ。ただし,電気分解を行うために十分な量の塩化銅($Ⅱ$)が溶けていたものとし,ファラデー定数は$9.65×10^4 C/mol$とする。また,流れた電流はすべて塩化銅($Ⅱ$)の電気分解に使われたものとする。
この動画を見る
Cl:35.5 Cu:64
炭素棒を電極として用い,塩化銅($Ⅱ$)水溶液の電気分解を行った。$0.50 A$の一定電流を$965$ 秒間流したとき,陰極で生じた物質の質量〔$g$〕として最も適当なものを,次の①~⑤のうちから一つ選べ。ただし,電気分解を行うために十分な量の塩化銅($Ⅱ$)が溶けていたものとし,ファラデー定数は$9.65×10^4 C/mol$とする。また,流れた電流はすべて塩化銅($Ⅱ$)の電気分解に使われたものとする。
【解答速報・全問解説】2025年 神奈川大学給費生試験 化学解答速報【化学のタカシー】

単元:
#化学#大学入試過去問(化学)#理科(高校生)#神奈川大学#大学入試解答速報#化学#神奈川大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
こちらの動画は、2024年12月22日(日)に実施された、2025年神奈川大学給費生試験の化学の解答速報です。
解説者は理数個別指導学院宮崎台校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
この動画を見る
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
こちらの動画は、2024年12月22日(日)に実施された、2025年神奈川大学給費生試験の化学の解答速報です。
解説者は理数個別指導学院宮崎台校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
無機化学基礎演習(19) ハロゲン単体・化合物の性質

単元:
#化学#無機#大学入試過去問(化学)#非金属元素の単体と化合物#理科(高校生)#神奈川大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
次の(1)~(5)の文中の空欄(a)~(e)にあてはまるもっとも適当なものを選択肢の中から1つずつ選びなさい。
(1)ハロゲンの単体のうち,沸点が最も低いものは(a)である。
①$Br_2$ ②$Cl_2$ ③$F_2$ ④$I_2$
(2)ハロゲンの単体のうち,水ともっとも激しく反応するものは(b)である。
①$Br_2$ ②$Cl_2$ ③$F_2$ ④$I_2$
(3)フッ化水素は(c)に濃硫酸を加えて加熱することで製造される。
①沸騰石 ②石灰石 ③ホタル石 ④ボーキサイト
(4)ハロゲン化水素のうち,沸点がもっとも高いものは(d)である。
①$HBr$ ②$HCl$ ③$HF$ ④$HI$
(5)塩素のオキソ酸のうち,酸性がもっとも強いものは(e)である。
①亜塩素酸 ②塩素酸 ③過塩素酸 ④過塩素酸
この動画を見る
次の(1)~(5)の文中の空欄(a)~(e)にあてはまるもっとも適当なものを選択肢の中から1つずつ選びなさい。
(1)ハロゲンの単体のうち,沸点が最も低いものは(a)である。
①$Br_2$ ②$Cl_2$ ③$F_2$ ④$I_2$
(2)ハロゲンの単体のうち,水ともっとも激しく反応するものは(b)である。
①$Br_2$ ②$Cl_2$ ③$F_2$ ④$I_2$
(3)フッ化水素は(c)に濃硫酸を加えて加熱することで製造される。
①沸騰石 ②石灰石 ③ホタル石 ④ボーキサイト
(4)ハロゲン化水素のうち,沸点がもっとも高いものは(d)である。
①$HBr$ ②$HCl$ ③$HF$ ④$HI$
(5)塩素のオキソ酸のうち,酸性がもっとも強いものは(e)である。
①亜塩素酸 ②塩素酸 ③過塩素酸 ④過塩素酸
【旧センター試験化学】2020追試 第1問 問5 凝固点降下度

単元:
#化学#大学入試過去問(化学)#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
物質A,B,Cについて,それぞれ質量モル濃度0.10 mol/kgの水溶液をつくり,凝固点降下度を測定した。その結果を以下に示す。ただし,物質A,B,Cは,2種類の電解質(電離度1)と1種類の非電解質である。この実験結果から推測される記述として,誤りを含むものを,下の①~④のうちから一つ選べ。
凝固点降下度〔K〕
物質Aの水溶液:0.57 物質Bの水溶液:0.19 物質Cの水溶液:0.38
①0.010 mol/kgのグルコース水溶液の凝固点降下度は0.019 Kである。
②0.010 mol/kgの酢酸水溶液の凝固点降下度は0.038 Kである。
③0.010 mol/kgの塩化カリウム水溶液の凝固点降下度は0.038 Kである。
④0.010 mol/kgの塩化マグネシウム水溶液の凝固点降下度は0.057 Kである。
この動画を見る
物質A,B,Cについて,それぞれ質量モル濃度0.10 mol/kgの水溶液をつくり,凝固点降下度を測定した。その結果を以下に示す。ただし,物質A,B,Cは,2種類の電解質(電離度1)と1種類の非電解質である。この実験結果から推測される記述として,誤りを含むものを,下の①~④のうちから一つ選べ。
凝固点降下度〔K〕
物質Aの水溶液:0.57 物質Bの水溶液:0.19 物質Cの水溶液:0.38
①0.010 mol/kgのグルコース水溶液の凝固点降下度は0.019 Kである。
②0.010 mol/kgの酢酸水溶液の凝固点降下度は0.038 Kである。
③0.010 mol/kgの塩化カリウム水溶液の凝固点降下度は0.038 Kである。
④0.010 mol/kgの塩化マグネシウム水溶液の凝固点降下度は0.057 Kである。
整数問題の難問!誘導なしで解けたらすごい! #Shorts #ずんだもん #勉強 #数学

単元:
#数A#大学入試過去問(数学)#整数の性質#約数・倍数・整数の割り算と余り・合同式#学校別大学入試過去問解説(数学)#数学(高校生)#大阪医科薬科大学
指導講師:
数学・算数の楽しさを思い出した / Ken
問題文全文(内容文):
3^x-2^y=1をみたす自然数x,yの組をすべて求めよ。
この動画を見る
3^x-2^y=1をみたす自然数x,yの組をすべて求めよ。
【旧センター試験化学】2019追試 第1問 問6 コロイドの生成実験

単元:
#化学#大学入試過去問(化学)#センター試験
指導講師:
問題文全文(内容文):
センター試験 2019 追試 第1問 問6
塩化鉄(Ⅲ)水溶液を沸騰水に加えて水酸化鉄(Ⅲ)のコロイド溶液を生成させた。このコロイド溶液をセロハンの袋に入れ,図1に示すように純水中で透析した後,次の実験Ⅰ・Ⅱを行った。これらの実験に関する記述として誤りを含むものを,次の①~④のうちから一つ選べ。
実験Ⅰ
(1) 透析後のコロイド溶液を3 mlずつ試験管A・Bにとった。
(2) Aに0.1 mol/Lの$Na_2SO_4$水溶液を加えると,沈殿が生じた。
(3) Bに0.2 mol/Lの$NaCl$水溶液を少量加えても,変化が生じなかった。
実験Ⅱ
(1) 透析後のビーカーに残った水を3 mlずつ試験管C・Dにとった。
(2) Cに硝酸銀水溶液を加えると,白濁した。
(3) DにBTB(ブロモチモールブルー)溶液を加えると,黄色に変色した。
①実験Ⅰより,このコロイド粒子は負に帯電していることがわかる。
②実験Ⅰより,$Na_2SO_4$水溶液の代わりに0.1 mol/Lの$K_2SO_4$水溶液を少量加えても,沈殿が生じることがわかる。
③実験Ⅱより,透析により塩化物イオンがセロハンを通過したことがわかる。
④実験Ⅱより,透析により水素イオンがセロハンを通過したことがわかる。
この動画を見る
センター試験 2019 追試 第1問 問6
塩化鉄(Ⅲ)水溶液を沸騰水に加えて水酸化鉄(Ⅲ)のコロイド溶液を生成させた。このコロイド溶液をセロハンの袋に入れ,図1に示すように純水中で透析した後,次の実験Ⅰ・Ⅱを行った。これらの実験に関する記述として誤りを含むものを,次の①~④のうちから一つ選べ。
実験Ⅰ
(1) 透析後のコロイド溶液を3 mlずつ試験管A・Bにとった。
(2) Aに0.1 mol/Lの$Na_2SO_4$水溶液を加えると,沈殿が生じた。
(3) Bに0.2 mol/Lの$NaCl$水溶液を少量加えても,変化が生じなかった。
実験Ⅱ
(1) 透析後のビーカーに残った水を3 mlずつ試験管C・Dにとった。
(2) Cに硝酸銀水溶液を加えると,白濁した。
(3) DにBTB(ブロモチモールブルー)溶液を加えると,黄色に変色した。
①実験Ⅰより,このコロイド粒子は負に帯電していることがわかる。
②実験Ⅰより,$Na_2SO_4$水溶液の代わりに0.1 mol/Lの$K_2SO_4$水溶液を少量加えても,沈殿が生じることがわかる。
③実験Ⅱより,透析により塩化物イオンがセロハンを通過したことがわかる。
④実験Ⅱより,透析により水素イオンがセロハンを通過したことがわかる。
【旧センター試験化学】2020追試 第1問 問2 メタンハイドレート

単元:
#化学#化学理論#大学入試過去問(化学)#気体の性質#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
センター試験化学 2020追試 第1問 問2
メタン$CH_4$は,定温・高圧下で水分子がつくる網目状構造に取り込まれて固体物質を形成する。この固体物質はメタンハイドレートと呼ばれ,$CH_4$と$H_2O$の質量比が16:104であることが知られている。
メタンハイドレート1.20 gのみが入っている容積1.0 Lの密閉容器を,27 ℃で静置したところ,メタンハイドレートは$CH_4$(気),$H_2O$(気),$H_2O$(液)となった。このとき,容器内の気体の全圧は何 Paか。最も適当な数値を,次の①~⑤のうちから一つ選べ。ただし,気体定数は$R=8.3 × 10^3 Pa・L/(K・mol)$であり,27 ℃における水蒸気圧は$3.6 × 10^3 Pa$である。また,$H_2O$(液)の体積,$H_2O$(液)への$CH_4$(気)の溶解は無視できるものとする。
① $3.6 × 10^3$ ② $2.5 × 10^4$ ③ $2.9 × 10^4$
④ $1.4 × 10^5$ ⑤ $1.7 × 10^5$
この動画を見る
センター試験化学 2020追試 第1問 問2
メタン$CH_4$は,定温・高圧下で水分子がつくる網目状構造に取り込まれて固体物質を形成する。この固体物質はメタンハイドレートと呼ばれ,$CH_4$と$H_2O$の質量比が16:104であることが知られている。
メタンハイドレート1.20 gのみが入っている容積1.0 Lの密閉容器を,27 ℃で静置したところ,メタンハイドレートは$CH_4$(気),$H_2O$(気),$H_2O$(液)となった。このとき,容器内の気体の全圧は何 Paか。最も適当な数値を,次の①~⑤のうちから一つ選べ。ただし,気体定数は$R=8.3 × 10^3 Pa・L/(K・mol)$であり,27 ℃における水蒸気圧は$3.6 × 10^3 Pa$である。また,$H_2O$(液)の体積,$H_2O$(液)への$CH_4$(気)の溶解は無視できるものとする。
① $3.6 × 10^3$ ② $2.5 × 10^4$ ③ $2.9 × 10^4$
④ $1.4 × 10^5$ ⑤ $1.7 × 10^5$
【旧センター試験化学】2020追試 第1問 問1 イオンの総電子数

単元:
#化学#大学入試過去問(化学)#原子の構成と元素の周期表#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
センター試験化学2020追試 第1問 問1
イオン1個に含まれる電子の総数が最も多いものを,次の①~④のうちから一つ選べ。ただし,塩素,カリウム,銅の原子番号はそれぞれ17,19,29である。
① $CO_3^{2-}$ ② $ClO^-$ ③ $Cu^{2+}$ ④ $K^+$
この動画を見る
センター試験化学2020追試 第1問 問1
イオン1個に含まれる電子の総数が最も多いものを,次の①~④のうちから一つ選べ。ただし,塩素,カリウム,銅の原子番号はそれぞれ17,19,29である。
① $CO_3^{2-}$ ② $ClO^-$ ③ $Cu^{2+}$ ④ $K^+$
理論化学基礎演習31 汗はどれだけ体温を下げるのか?

単元:
#化学#化学理論#大学入試過去問(化学)#物質の変化と熱・光#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
2024 崇城大学
汗が蒸発するときに周囲から奪った熱が,$1.1 × 10^3 kJ$であった。37 ℃の水50 kgから$1.1 × 10^3 kJ$の熱量が奪われたとき,水50 kgは冷却されて理論上何 ℃となるか。水1.0 gの温度を1.0 K上げるのに必要な熱量を4.2 Jとし,温度に依存しないとする。
この動画を見る
2024 崇城大学
汗が蒸発するときに周囲から奪った熱が,$1.1 × 10^3 kJ$であった。37 ℃の水50 kgから$1.1 × 10^3 kJ$の熱量が奪われたとき,水50 kgは冷却されて理論上何 ℃となるか。水1.0 gの温度を1.0 K上げるのに必要な熱量を4.2 Jとし,温度に依存しないとする。
【旧センター試験化学】2019追試 第7問 問2 DNAに含まれる水素結合の数を数えよう!

単元:
#化学#大学入試過去問(化学)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
センター試験化学 2019年追試 第7問 問2
DNAは,2本のポリヌクレオチド鎖が塩基の間で水素結合をつくり,二重らせん構造を形成している。DNAのヌクレオチド中の塩基には,図1(図は動画参照)に示すア~エの4種類があり,塩基の$N$原子に結合している$H$原子($NーH$)と,異なる塩基の$N$原子あるいは$O$原子との間で,$NーH\cdots O$
この動画を見る
センター試験化学 2019年追試 第7問 問2
DNAは,2本のポリヌクレオチド鎖が塩基の間で水素結合をつくり,二重らせん構造を形成している。DNAのヌクレオチド中の塩基には,図1(図は動画参照)に示すア~エの4種類があり,塩基の$N$原子に結合している$H$原子($NーH$)と,異なる塩基の$N$原子あるいは$O$原子との間で,$NーH\cdots O$
理論化学基礎演習30 純水や塩酸に溶けるAgClの量

単元:
#化学#大学入試過去問(化学)#理科(高校生)#昭和薬科大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
2021 昭和薬科大学(改)
AgClの式量 $143.5 Ksp 1.8×10^-10 (mol/L)^2$
それぞれ有効数字2桁で答えよ。
(1)純粋な水1.0 Lに対してAgClは何 g溶解するか。ただし,$\sqrt{1.8}=1.3$とする。
(2)0.10 mol/Lの硫酸1.0 Lに対してAgClは何 g溶解するか。ただし,溶解するAgClの濃度は塩酸の濃度に比べて十分に小さく,AgClの溶解により水溶液の体積は変化しないものとする。
この動画を見る
2021 昭和薬科大学(改)
AgClの式量 $143.5 Ksp 1.8×10^-10 (mol/L)^2$
それぞれ有効数字2桁で答えよ。
(1)純粋な水1.0 Lに対してAgClは何 g溶解するか。ただし,$\sqrt{1.8}=1.3$とする。
(2)0.10 mol/Lの硫酸1.0 Lに対してAgClは何 g溶解するか。ただし,溶解するAgClの濃度は塩酸の濃度に比べて十分に小さく,AgClの溶解により水溶液の体積は変化しないものとする。
有機化学基礎演習(23) アルカンの塩素置換

単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
関西大学 H 1 C 12 Cl 35.5 空欄を埋めてください。
メタンと塩素の混合気体に光を照射すると,置換反応が起きる。
メタンの1個の水素原子が1個の塩素原子に置き換わる反応は以下の反応式で表される。
{ }
同様の方法でn₌4の直鎖状アルカンの1個の水素原子を
1個の塩素原子で置換すると,立体異性体を区別しなければ,
( )種類の生成物が得られる。いま,n₌4の直鎖状アルカン5.80gを
塩素と混合した後,光を照射した。ここで,このアルカンの1個の
水素原子を1個の塩素原子で置換した生成物と未反応のアルカンの混合物が
7.87g得られたとする。このとき,n₌4の直鎖状アルカンの[ ]%が
反応したと計算できる。
この動画を見る
関西大学 H 1 C 12 Cl 35.5 空欄を埋めてください。
メタンと塩素の混合気体に光を照射すると,置換反応が起きる。
メタンの1個の水素原子が1個の塩素原子に置き換わる反応は以下の反応式で表される。
{ }
同様の方法でn₌4の直鎖状アルカンの1個の水素原子を
1個の塩素原子で置換すると,立体異性体を区別しなければ,
( )種類の生成物が得られる。いま,n₌4の直鎖状アルカン5.80gを
塩素と混合した後,光を照射した。ここで,このアルカンの1個の
水素原子を1個の塩素原子で置換した生成物と未反応のアルカンの混合物が
7.87g得られたとする。このとき,n₌4の直鎖状アルカンの[ ]%が
反応したと計算できる。
1分で解いてほしい化学計算問題 (75) 溶解度曲線

単元:
#化学#化学理論#大学入試過去問(化学)#溶液の性質#理科(高校生)#麻布大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
硝酸カリウムの個体結晶210gを80℃のみず150gに完全に溶解させて溶液全体が
360gになる硝酸カリウム水溶液を調製した。この溶液の温度を80℃付近から
徐々に低下させると,溶液の温度が何℃より低くなったときに固体の硝酸カリウム
が析出し始めるか。[2024 麻布大学]
(図は動画参照)
この動画を見る
硝酸カリウムの個体結晶210gを80℃のみず150gに完全に溶解させて溶液全体が
360gになる硝酸カリウム水溶液を調製した。この溶液の温度を80℃付近から
徐々に低下させると,溶液の温度が何℃より低くなったときに固体の硝酸カリウム
が析出し始めるか。[2024 麻布大学]
(図は動画参照)
理論化学基礎演習28 生理食塩水と同じ濃度のグルコース溶液を調製するには?

単元:
#化学#化学理論#大学入試過去問(化学)#溶液の性質#理科(高校生)#昭和薬科大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
(問題)塩化ナトリウム9.0gを水に溶解させ全量1000mLにした食塩水がある。この溶液と
浸透圧が等しいグルコース水溶液を作りたい。18gのグルコースをすべて使う場合,グルコース
水溶液の全量は何mLにすればよいか。以下のうち,最も近い数値を選び,番号を
マークしなさい。ただし,塩化ナトリウムは完全に電離しているものとする。※温度は等しい
(原子量 H 1 C 12 O 16 Na 23 Cl 35.5)
① 163 ② 325 ③ 650 ④ 1580 ⑤ 3240 ⑥ 3600
この動画を見る
(問題)塩化ナトリウム9.0gを水に溶解させ全量1000mLにした食塩水がある。この溶液と
浸透圧が等しいグルコース水溶液を作りたい。18gのグルコースをすべて使う場合,グルコース
水溶液の全量は何mLにすればよいか。以下のうち,最も近い数値を選び,番号を
マークしなさい。ただし,塩化ナトリウムは完全に電離しているものとする。※温度は等しい
(原子量 H 1 C 12 O 16 Na 23 Cl 35.5)
① 163 ② 325 ③ 650 ④ 1580 ⑤ 3240 ⑥ 3600
【日本最速解答速報】2025年星薬科大学薬学部薬学科(6年制) 学校推薦型選抜 化学 解答速報【化学のタカシー】

単元:
#化学#大学入試過去問(化学)#理科(高校生)#大学入試解答速報#化学#星薬科大学#星薬科大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
こちらの動画は、2024年11月24日(日)に実施された、2025年星薬科大学薬学部薬学科(6年制)学校推薦型選抜の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院宮崎台校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
この動画を見る
こちらの動画は、2024年11月24日(日)に実施された、2025年星薬科大学薬学部薬学科(6年制)学校推薦型選抜の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院宮崎台校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
【旧センター試験化学】2019追試 第4問 問4 C₆H₁₀の構造異性体の数(条件付き)

単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#脂肪族炭化水素#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
分子式がC₆H₁₀である化合物の構造異性体のうち,環状構造を一つだけもち,
その環状構造が五つの炭素原子からなるものはいくつあるか,正しい数を,
次の①~⑥のうちから一つ選べ。ただし,立体異性体は考えないものとする。
① 1 ② 2 ③ 3 ④ 4 ⑤ 5 ⑥ 6
この動画を見る
分子式がC₆H₁₀である化合物の構造異性体のうち,環状構造を一つだけもち,
その環状構造が五つの炭素原子からなるものはいくつあるか,正しい数を,
次の①~⑥のうちから一つ選べ。ただし,立体異性体は考えないものとする。
① 1 ② 2 ③ 3 ④ 4 ⑤ 5 ⑥ 6
【旧センター試験化学】2019追試 第4問 問3 カルボン酸の性質

単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
カルボン酸の記述として下線部に誤りを含むものを,次の①~⑤のうちから一つ選べ。
① ギ酸は,還元性を示す。
② リノレン酸 C₁₇H₂₉COOHは,炭素原子間に二重結合を三つもつ。
③ 乳酸 CH₃CH(OH)COOHには,光学異性体(鏡像異性体)が存在する。
④ 高級脂肪酸のナトリウム塩は,油汚れなどを落とすことが出来る。
⑤ ともに示性式C₂H₂(COOH)₂で表されるマレイン酸とフマル酸は,いずれも分子内で脱水して酸無水物をつくることができる。
(下線部は動画参照)
この動画を見る
カルボン酸の記述として下線部に誤りを含むものを,次の①~⑤のうちから一つ選べ。
① ギ酸は,還元性を示す。
② リノレン酸 C₁₇H₂₉COOHは,炭素原子間に二重結合を三つもつ。
③ 乳酸 CH₃CH(OH)COOHには,光学異性体(鏡像異性体)が存在する。
④ 高級脂肪酸のナトリウム塩は,油汚れなどを落とすことが出来る。
⑤ ともに示性式C₂H₂(COOH)₂で表されるマレイン酸とフマル酸は,いずれも分子内で脱水して酸無水物をつくることができる。
(下線部は動画参照)
【旧センター試験化学】2019追試 第4問 問1 有機化合物の立体構造

単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
四つの炭素原子が同一直線状にある構造をもつ化合物を,次の①~⑤のうちから一つ選べ。
① ブタン CH₃CH₂CH₂CH₃
② 1-ブテン CH₂=CHCH₂CH₃
③ 2-ブテン CH₃CH=CHCH₃
④ 1-ブチン CH≡CCH₂CH₃
⑤ 2-ブチン CH₃C≡CCH₃
この動画を見る
四つの炭素原子が同一直線状にある構造をもつ化合物を,次の①~⑤のうちから一つ選べ。
① ブタン CH₃CH₂CH₂CH₃
② 1-ブテン CH₂=CHCH₂CH₃
③ 2-ブテン CH₃CH=CHCH₃
④ 1-ブチン CH≡CCH₂CH₃
⑤ 2-ブチン CH₃C≡CCH₃
理論化学基礎演習25 沸点の高低はどのように判断するか?

単元:
#化学#大学入試過去問(化学)#理科(高校生)#東京薬科大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
記述a~cの正誤を答えなさい。
a ジメチルエーテルとエタノールでは,エタノールの方が沸点が高い。
b ネオンとアルゴンでは,アルゴンの方が沸点が高い。
c フッ化水素と塩化水素では,フッ化水素の方が沸点が高い。
この動画を見る
記述a~cの正誤を答えなさい。
a ジメチルエーテルとエタノールでは,エタノールの方が沸点が高い。
b ネオンとアルゴンでは,アルゴンの方が沸点が高い。
c フッ化水素と塩化水素では,フッ化水素の方が沸点が高い。
【旧センター試験化学】2019追試 第3問 問5 アルミニウムの溶融塩電解
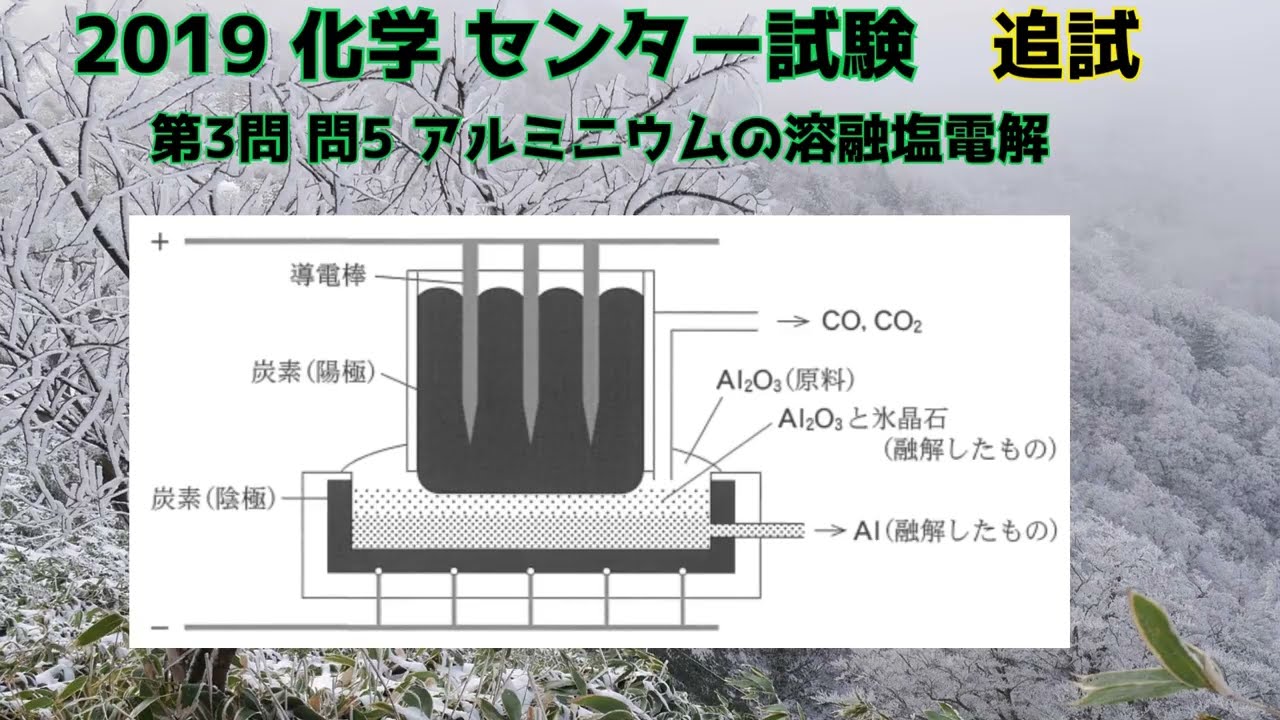
単元:
#化学#無機#大学入試過去問(化学)#酸化還元反応#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
酸化アルミニウムAl₂O₃を原料とした融解塩電解(溶融塩電解)によるアルミニウムAlの製造は,図1のような装置で行われ,陽極の炭素Cは次の反応のいずれかにより酸化される。
C + O²⁻ → CO + 2e⁻
C + 2O²⁻ → CO₂ + 4e⁻
陽極で発生した気体が,CO 14 kgとCO₂ 66 kgの混合気体のとき,陰極側に生成した金属Alの質量は何kgか。最も適当な数値を,下の①~⑥のうちから一つ選べ。ただし,酸化アルミニウムを融解させるために添加された氷晶石の質量は変化せず,反応した酸化アルミニウムに含まれる酸素は,すべて陽極の炭素の酸化に使用されたものとする。
① 18
② 27
③ 32
④ 45
⑤ 54
⑥ 63
この動画を見る
酸化アルミニウムAl₂O₃を原料とした融解塩電解(溶融塩電解)によるアルミニウムAlの製造は,図1のような装置で行われ,陽極の炭素Cは次の反応のいずれかにより酸化される。
C + O²⁻ → CO + 2e⁻
C + 2O²⁻ → CO₂ + 4e⁻
陽極で発生した気体が,CO 14 kgとCO₂ 66 kgの混合気体のとき,陰極側に生成した金属Alの質量は何kgか。最も適当な数値を,下の①~⑥のうちから一つ選べ。ただし,酸化アルミニウムを融解させるために添加された氷晶石の質量は変化せず,反応した酸化アルミニウムに含まれる酸素は,すべて陽極の炭素の酸化に使用されたものとする。
① 18
② 27
③ 32
④ 45
⑤ 54
⑥ 63
理論化学基礎演習24 ¹²C = 12が ¹²C = 120に変更され,120gの¹²Cが1molになったらどうなるか?

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#物質量と濃度
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
仮に,相対質量の基準値を¹²C=12から¹²C=120に変更し,さらに¹²C 1molの質量を12gから120gに変更した場合,
①質量パーセント濃度が1.80%のグルコース水溶液におけるモル凝固点降下
②4.00g/Lの水溶液のpH
それぞれどうなるか。以下の選択肢から選びなさい。(変更前のNaOHの式量は40)
100倍になる,10倍になる,1増加する,1減少する,10分の1になる,100分の1になる
この動画を見る
仮に,相対質量の基準値を¹²C=12から¹²C=120に変更し,さらに¹²C 1molの質量を12gから120gに変更した場合,
①質量パーセント濃度が1.80%のグルコース水溶液におけるモル凝固点降下
②4.00g/Lの水溶液のpH
それぞれどうなるか。以下の選択肢から選びなさい。(変更前のNaOHの式量は40)
100倍になる,10倍になる,1増加する,1減少する,10分の1になる,100分の1になる
