 大学入試過去問(化学)
大学入試過去問(化学)
 大学入試過去問(化学)
大学入試過去問(化学)
1分で解いてほしい化学計算問題 (73) 分子の数

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#物質量と濃度#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
1gに含まれる分子の数が最も多い物質を選びなさい。
(原子量 H 1 C 12 N 14 O 16 Ne 20 Cl 35.5 アボガドロ定数 6.0×10²³ /mol)
①塩素 ②酸素 ③窒素 ④二酸化炭素
⑤水 ⑥アンモニア ⑦ネオン ⑧メタン
この動画を見る
1gに含まれる分子の数が最も多い物質を選びなさい。
(原子量 H 1 C 12 N 14 O 16 Ne 20 Cl 35.5 アボガドロ定数 6.0×10²³ /mol)
①塩素 ②酸素 ③窒素 ④二酸化炭素
⑤水 ⑥アンモニア ⑦ネオン ⑧メタン
共通テストまであと68日 NG行動とは?

単元:
#大学入試過去問(数学)#物理#化学#生物#センター試験・共通テスト関連#共通テスト#大学入試過去問(物理)#大学入試過去問(化学)#英語(高校生)#国語(高校生)#社会(高校生)#日本史#世界史#大学入試過去問(英語)#大学入試過去問(国語)#共通テスト#共通テスト(現代文)#大学入試過去問(生物)#共通テスト・センター試験#共通テスト(古文)#共通テスト#大学入試過去問・共通テスト・模試関連#大学入試過去問・共通テスト・模試関連#数学(高校生)#理科(高校生)#共通テスト
指導講師:
カサニマロ【べんとう・ふきのとうの授業動画】
問題文全文(内容文):
共通テスト前のNG行動
この動画を見る
共通テスト前のNG行動
【高校化学】少ない暗記量で得点源にする糖類の解説(7)デンプン関連の計算問題をマスターしよう!

単元:
#化学#大学入試過去問(化学)#理科(高校生)#順天堂大学#工学院大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
デンプン100gを完全に加水分解すると何gのグルコース得られるか。有効数字2桁で答えよ。(2024 工学院大学)
9.72gのアメロペクチンAのヒドロキシ基をすべてCH₃O⁻(メトキシ基)にした後に希硫酸で完全に加水分解すると,分子量の異なるB, C, Dが得られ,CはDよりも多くのヒドロキシ基を持っていた。それぞれの収量はBが12.25g,Cが0.499g,Dが0.566gであった。なお,図中の①に相当する炭素に結合しているメトキシ基以外は加水分解を受けない。Aはグルコース単位で平均何個ごとに枝分かれするか。(2024 順天堂大学)
この動画を見る
デンプン100gを完全に加水分解すると何gのグルコース得られるか。有効数字2桁で答えよ。(2024 工学院大学)
9.72gのアメロペクチンAのヒドロキシ基をすべてCH₃O⁻(メトキシ基)にした後に希硫酸で完全に加水分解すると,分子量の異なるB, C, Dが得られ,CはDよりも多くのヒドロキシ基を持っていた。それぞれの収量はBが12.25g,Cが0.499g,Dが0.566gであった。なお,図中の①に相当する炭素に結合しているメトキシ基以外は加水分解を受けない。Aはグルコース単位で平均何個ごとに枝分かれするか。(2024 順天堂大学)
共通テスト直前死ぬほど伸びる人の特徴【1.5倍速推奨】

単元:
#大学入試過去問(数学)#物理#化学#生物#センター試験・共通テスト関連#共通テスト#大学入試過去問(物理)#大学入試過去問(化学)#英語(高校生)#国語(高校生)#社会(高校生)#日本史#世界史#大学入試過去問(英語)#大学入試過去問(国語)#共通テスト#共通テスト(現代文)#大学入試過去問(生物)#共通テスト・センター試験#共通テスト(古文)#共通テスト#大学入試過去問・共通テスト・模試関連#大学入試過去問・共通テスト・模試関連#数学(高校生)#理科(高校生)#共通テスト
指導講師:
カサニマロ【べんとう・ふきのとうの授業動画】
問題文全文(内容文):
共通テスト直前で点数が伸びる人の特徴
この動画を見る
共通テスト直前で点数が伸びる人の特徴
【旧センター試験化学】2019追試 第3問 問4 金属イオンの反応

単元:
#化学#大学入試過去問(化学)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
4種類の水溶液ア,イ,ウ,エは,それぞれKBr,KOH,Na (Al OH)₄] ,Na₂SO₄のいずれかの水溶液である。ア~エを区別するため,次の実験Ⅰ・Ⅱを行った。ア~エの溶質の組合せとして最も適当なものを,下の①~⑧のなかから一つ選べ。
実験Ⅰ ア~エに希硫酸を少しずつ加えたところ,エのみが白色ゲル状(ゼリー状)の沈殿を生じ,さらに希塩酸を加えるとこの沈殿は溶けた。
実験Ⅱ ア~ウに硫酸銀水溶液を加えたところ,アには変化がなかったが,イは褐色の沈殿が生じ,ウは淡黄色の沈殿を生じた。
①アKBr イKOH ウNa (Al OH)₄] エNa₂SO₄
②アKBr イNa (Al OH)₄] ウNa₂SO₄ エKOH
③アKOH イKBrウNa₂SO₄エNa (Al OH)₄]
④アKOH イNa₂SO₄ウNa (Al OH)₄]エKBr
⑤アNa (Al OH)₄] イKBr ウKOH エNa₂SO₄
⑥アNa (Al OH)₄] イNa₂SO₄ ウKBr エKOH
⑦アNa₂SO₄ イKOH ウKBr エNa (Al OH)₄]
⑧アNa₂SO₄ イNa (Al OH)₄] ウKOH エKBr
この動画を見る
4種類の水溶液ア,イ,ウ,エは,それぞれKBr,KOH,Na (Al OH)₄] ,Na₂SO₄のいずれかの水溶液である。ア~エを区別するため,次の実験Ⅰ・Ⅱを行った。ア~エの溶質の組合せとして最も適当なものを,下の①~⑧のなかから一つ選べ。
実験Ⅰ ア~エに希硫酸を少しずつ加えたところ,エのみが白色ゲル状(ゼリー状)の沈殿を生じ,さらに希塩酸を加えるとこの沈殿は溶けた。
実験Ⅱ ア~ウに硫酸銀水溶液を加えたところ,アには変化がなかったが,イは褐色の沈殿が生じ,ウは淡黄色の沈殿を生じた。
①アKBr イKOH ウNa (Al OH)₄] エNa₂SO₄
②アKBr イNa (Al OH)₄] ウNa₂SO₄ エKOH
③アKOH イKBrウNa₂SO₄エNa (Al OH)₄]
④アKOH イNa₂SO₄ウNa (Al OH)₄]エKBr
⑤アNa (Al OH)₄] イKBr ウKOH エNa₂SO₄
⑥アNa (Al OH)₄] イNa₂SO₄ ウKBr エKOH
⑦アNa₂SO₄ イKOH ウKBr エNa (Al OH)₄]
⑧アNa₂SO₄ イNa (Al OH)₄] ウKOH エKBr
有機化学基礎演習(20) 定番のPET (ポリエチレンテレフタラート) エステル結合の数や平均重合度の計算です

単元:
#化学#大学入試過去問(化学)#化学(高分子)#合成繊維と天然繊維#理科(高校生)#神戸薬科大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
2024 神戸薬科大学(一部改題) 原子量H 1C 12Ο 16
テレフタル酸とエチレングリコール(C₂H₃O₂)の重合によって、ペットボトルの原料として利用される 合成繊維ポリエチレンテレフタラート(略称:PET)が合成された。このPETの平均分子量を調べたところ、5.00×10⁴であった。このPETの平均重合度はいくらか。また、1分子の PETに含まれるエステル結合の数は平均でいくらか。正しい組み合わせを選べ。ただし、 PETの末端の構造については、考慮する必要はないものとする。
平均重合度, 含まれるエステル結合の数
①197, 197
②197, 394
③224, 224
④224, 448
⑤260, 260
⑥260, 520
⑦292, 292
⑧292, 584
⑨342, 342
⑩342, 684
この動画を見る
2024 神戸薬科大学(一部改題) 原子量H 1C 12Ο 16
テレフタル酸とエチレングリコール(C₂H₃O₂)の重合によって、ペットボトルの原料として利用される 合成繊維ポリエチレンテレフタラート(略称:PET)が合成された。このPETの平均分子量を調べたところ、5.00×10⁴であった。このPETの平均重合度はいくらか。また、1分子の PETに含まれるエステル結合の数は平均でいくらか。正しい組み合わせを選べ。ただし、 PETの末端の構造については、考慮する必要はないものとする。
平均重合度, 含まれるエステル結合の数
①197, 197
②197, 394
③224, 224
④224, 448
⑤260, 260
⑥260, 520
⑦292, 292
⑧292, 584
⑨342, 342
⑩342, 684
理論化学基礎演習21 溶解度積の計算

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
2024 金沢医科大学(医)
室温において、1 * 10 ^ - 5 * mol / Lの硝酸銀 AgNO3 水溶液30mLに、ある濃度の塩化ナトリウム水溶液を加えていくと、20mLを超えた時点で塩化銀 AgClの沈殿が生じ始めた。NaCl 水溶液のモル濃度は何mol/Lか。ただし、室温での AgCl の溶解度積 Kspは 1.8 * 10 ^ - 10 * (mol / L) ^ 2 とする。
この動画を見る
2024 金沢医科大学(医)
室温において、1 * 10 ^ - 5 * mol / Lの硝酸銀 AgNO3 水溶液30mLに、ある濃度の塩化ナトリウム水溶液を加えていくと、20mLを超えた時点で塩化銀 AgClの沈殿が生じ始めた。NaCl 水溶液のモル濃度は何mol/Lか。ただし、室温での AgCl の溶解度積 Kspは 1.8 * 10 ^ - 10 * (mol / L) ^ 2 とする。
【旧センター試験化学】2019追試 第3問 問2 気体発生の反応
単元:
#化学#無機#有機#大学入試過去問(化学)#酸素を含む脂肪族化合物#非金属元素の単体と化合物#典型金属元素の単体と化合物#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
気体が発生する化学反応に関する記述として誤りを含むものを,次の①から④のうちから一つ選べ。
① 硫黄を空気中で激しく燃焼させると,二酸化硫黄が発生する。
② フッ素と水は激しく反応し,酸素が発生する。
③ 銀に濃硝酸を加えると,二酸化窒素が発生する。
④ ギ酸に希硫酸を加えると,一酸化炭素が発生する。
この動画を見る
気体が発生する化学反応に関する記述として誤りを含むものを,次の①から④のうちから一つ選べ。
① 硫黄を空気中で激しく燃焼させると,二酸化硫黄が発生する。
② フッ素と水は激しく反応し,酸素が発生する。
③ 銀に濃硝酸を加えると,二酸化窒素が発生する。
④ ギ酸に希硫酸を加えると,一酸化炭素が発生する。
【旧センター試験化学】2019追試 第2問 問4 圧平衡定数

単元:
#化学#大学入試過去問(化学)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
容積一定の密閉容器中で、物質量比1:3のN」とHを反応させたとき、平衡状態では$p_N₂ = 1.0×10^5 $Pa. $P_H₂= 3.0 × 10^5$ Paであった。このときの平衡定数を$K_p=3.0 × 10^{-10} $Pa$^{-2}$とすると、最初に容器内にあったN₂ の物質量の何%がNH$ _2$に変化したか。最も適当な数値を、次の①~⑤のうちから一つ選べ。
この動画を見る
容積一定の密閉容器中で、物質量比1:3のN」とHを反応させたとき、平衡状態では$p_N₂ = 1.0×10^5 $Pa. $P_H₂= 3.0 × 10^5$ Paであった。このときの平衡定数を$K_p=3.0 × 10^{-10} $Pa$^{-2}$とすると、最初に容器内にあったN₂ の物質量の何%がNH$ _2$に変化したか。最も適当な数値を、次の①~⑤のうちから一つ選べ。
【旧センター試験化学】2019追試 第2問 問2 ダニエル電池

単元:
#化学#大学入試過去問(化学)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問2
図1(問題文の図参照)に示すように,素焼きの板で仕切られた容器の一方に硫酸亜鉛水溶液を入れて亜鉛板を浸し,もう一方に硫酸銅(Ⅱ)水溶液を入れて銅板を浸した後,これらの金属板を豆電球を導線でつないだ。このとき,導線を流れた電流の向き(アまたはイ)および放電後の亜鉛版と銅板の合計質量の変化の組合せとして最も適切なものを,下の①~⑥のうちから一つ選べ。
① ア 増加する
② ア 変化しない
③ ア 減少する
④ イ 増加する
⑤ イ 変化しない
⑥ イ 減少する
この動画を見る
問2
図1(問題文の図参照)に示すように,素焼きの板で仕切られた容器の一方に硫酸亜鉛水溶液を入れて亜鉛板を浸し,もう一方に硫酸銅(Ⅱ)水溶液を入れて銅板を浸した後,これらの金属板を豆電球を導線でつないだ。このとき,導線を流れた電流の向き(アまたはイ)および放電後の亜鉛版と銅板の合計質量の変化の組合せとして最も適切なものを,下の①~⑥のうちから一つ選べ。
① ア 増加する
② ア 変化しない
③ ア 減少する
④ イ 増加する
⑤ イ 変化しない
⑥ イ 減少する
有機化学基礎演習(18) NBRのアクリロニトリルとブタジエンの構成比を計算しよう!

単元:
#化学#大学入試過去問(化学)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
1,3-ブタジエンとアクリロニトリルの共重合により,平均分子量が53000の共重合体であるアクリロニトリルーブタジエンゴム(通称NBR)が得られた。NBRは石油ホースなどに用いられる。この共重合体の元素分析を行ったところ,成分元素である窒素原子の質量%は11.9%であった。
(1)共重合体中のアクリロニトリルに由来する成分の含有量の質量%を計算せよ。答えは有効数字2桁で書け。
(2)共重合体の1分子中に含まれるブタジエン単位の平均の数(個)を計算せよ。答えは有効数字2桁とし,2.1×10³のように書け。
この動画を見る
1,3-ブタジエンとアクリロニトリルの共重合により,平均分子量が53000の共重合体であるアクリロニトリルーブタジエンゴム(通称NBR)が得られた。NBRは石油ホースなどに用いられる。この共重合体の元素分析を行ったところ,成分元素である窒素原子の質量%は11.9%であった。
(1)共重合体中のアクリロニトリルに由来する成分の含有量の質量%を計算せよ。答えは有効数字2桁で書け。
(2)共重合体の1分子中に含まれるブタジエン単位の平均の数(個)を計算せよ。答えは有効数字2桁とし,2.1×10³のように書け。
【旧センター試験化学】2019追試 第2問 問1 燃料の燃焼と熱量

単元:
#化学#大学入試過去問(化学)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問1
プロパンC₃H₈とブタンC₄H₁₀からなる混合気体があり,その体積は0℃,1.013×10⁵Paで44.8Lである。この混合気体を完全燃焼させたところ,5380kJの熱量が発生した。プロパンとブタンの燃焼熱はそれぞれ2200kJ/mol,2900kJ/molである。混合気体中のプロパンの物質量(mol)と完全燃焼で消費された酸素の物質量(mol)の数値の組合せとして最も適切なものを,次の①~⑥のうちから一つ選べ。
混合気体中のプロパンの物質量 消費された酸素の物質量
① 0.600 7.40
② 0.600 12.1
③ 0.600 16.8
④ 1.40 6.6
⑤ 1.40 10.9
⑥ 1.40 15.2
この動画を見る
問1
プロパンC₃H₈とブタンC₄H₁₀からなる混合気体があり,その体積は0℃,1.013×10⁵Paで44.8Lである。この混合気体を完全燃焼させたところ,5380kJの熱量が発生した。プロパンとブタンの燃焼熱はそれぞれ2200kJ/mol,2900kJ/molである。混合気体中のプロパンの物質量(mol)と完全燃焼で消費された酸素の物質量(mol)の数値の組合せとして最も適切なものを,次の①~⑥のうちから一つ選べ。
混合気体中のプロパンの物質量 消費された酸素の物質量
① 0.600 7.40
② 0.600 12.1
③ 0.600 16.8
④ 1.40 6.6
⑤ 1.40 10.9
⑥ 1.40 15.2
【旧センター試験化学】2019追試 第1問 問4 結晶と非晶質

単元:
#化学#大学入試過去問(化学)#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問4
いろいろな物質の結晶・非晶質に関する記述として誤りを含むものを,次の①~⑤のうちから一つ選べ。
①共有結合できている結晶には,分子結晶に比べて融点が高いものが多い。
②金属結晶では,両心立方格子をとる原子の配位数は体心立方格子をとる原子の配位数より多い。
③イオン結晶では,単位格子に含まれる陽イオンと陰イオンの数の比は,組成式で示されるイオンの数の比に等しい。
④すべての単体の結晶は共有結合でできている。
⑤非晶質は一定の融点を示さない。
この動画を見る
問4
いろいろな物質の結晶・非晶質に関する記述として誤りを含むものを,次の①~⑤のうちから一つ選べ。
①共有結合できている結晶には,分子結晶に比べて融点が高いものが多い。
②金属結晶では,両心立方格子をとる原子の配位数は体心立方格子をとる原子の配位数より多い。
③イオン結晶では,単位格子に含まれる陽イオンと陰イオンの数の比は,組成式で示されるイオンの数の比に等しい。
④すべての単体の結晶は共有結合でできている。
⑤非晶質は一定の融点を示さない。
【旧センター試験化学】2019追試 第1問 問3 密閉容器内の圧力

単元:
#化学#大学入試過去問(化学)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問3
容積を変えられる密閉容器に入れた水が,気液平衡の状態にある。次の操作Ⅰ・Ⅱにより,水蒸気の圧力はそれぞれ何Paになるか。圧力の数値の組合せとして最も適切なものを,下の①~⑥のうちから一つ選べ。ただし,水の蒸気圧は20℃で2.3×10³Paであり,100℃で1.0×10⁵Paである。また,密閉容器内には常に液体の水が存在し,その体積は無視できるものとする。操作後はすみやかに気液平衡の状態になるものとする。
操作Ⅰ 容器内の温度を20℃に保ち,容器の容積を1.0Lから0.500Lに減少させた。
操作Ⅱ 容器の容積を1.0Lに保ち,容器内の温度を20℃から100℃に上昇させた。
この動画を見る
問3
容積を変えられる密閉容器に入れた水が,気液平衡の状態にある。次の操作Ⅰ・Ⅱにより,水蒸気の圧力はそれぞれ何Paになるか。圧力の数値の組合せとして最も適切なものを,下の①~⑥のうちから一つ選べ。ただし,水の蒸気圧は20℃で2.3×10³Paであり,100℃で1.0×10⁵Paである。また,密閉容器内には常に液体の水が存在し,その体積は無視できるものとする。操作後はすみやかに気液平衡の状態になるものとする。
操作Ⅰ 容器内の温度を20℃に保ち,容器の容積を1.0Lから0.500Lに減少させた。
操作Ⅱ 容器の容積を1.0Lに保ち,容器内の温度を20℃から100℃に上昇させた。
【旧センター試験化学】2018追試 第7問 問2 グルコースの燃焼とアルコール発酵

【旧センター試験化学】2018追試 第7問 問1 グルコースとセルロース

単元:
#化学#大学入試過去問(化学)#化学(高分子)#糖類#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問1 デンプンとセルロースに関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① デンプンは、α-グルコースが縮合重合した高分子化合物で、らせん状の構造をもつ。
② デンプンは、希硫酸を加えて加熱すると加水分解される。
③ セルロースは、β-グルコースが縮合重合した高分子化合物で、直線状の構造をもつ。
④ 銅アンモニアレーヨンとビスコースレーヨンは、いずれも繰り返し単位の構造がセルロースとは異なる。
この動画を見る
問1 デンプンとセルロースに関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① デンプンは、α-グルコースが縮合重合した高分子化合物で、らせん状の構造をもつ。
② デンプンは、希硫酸を加えて加熱すると加水分解される。
③ セルロースは、β-グルコースが縮合重合した高分子化合物で、直線状の構造をもつ。
④ 銅アンモニアレーヨンとビスコースレーヨンは、いずれも繰り返し単位の構造がセルロースとは異なる。
【旧センター試験化学】2018追試 第5問 問2 天然高分子化合物

単元:
#化学#大学入試過去問(化学)#化学(高分子)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
天然に存在する有機化合物のうち、次の条件a~cをすべて満たす化合物として最も適当なものを、下の①~⑥のうちから一つ選べ。
a 不斉炭素原子を有する。
b ニンヒドリン溶液を加えて温めると呈色する。
c 水溶液では、その分子の電荷が全体としてゼロとなるpHの値が5より大きい。
① アラニン
② ガラクトース
③ グリシン
④ グルコース
⑤ グルタミン酸
⑥ フルクトース
この動画を見る
天然に存在する有機化合物のうち、次の条件a~cをすべて満たす化合物として最も適当なものを、下の①~⑥のうちから一つ選べ。
a 不斉炭素原子を有する。
b ニンヒドリン溶液を加えて温めると呈色する。
c 水溶液では、その分子の電荷が全体としてゼロとなるpHの値が5より大きい。
① アラニン
② ガラクトース
③ グリシン
④ グルコース
⑤ グルタミン酸
⑥ フルクトース
【テーマ別解説】化学・入試に出る白色沈殿

有機化学基礎演習16 アルキンC₄H₆と付加反応後の異性体の数

単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
(問題) 分子式がC4H6で示されるアルキンには( 2 or 3 ) 種類の構造異性体が存在する。また、C4H6のアルキンに1分子の臭化水素HBrを付加させたときに生じる分子式がC4HBrで示される化合物には、シスートランス異性体を含め(5 or 6 ) 種類の構造が考えられる。
この動画を見る
(問題) 分子式がC4H6で示されるアルキンには( 2 or 3 ) 種類の構造異性体が存在する。また、C4H6のアルキンに1分子の臭化水素HBrを付加させたときに生じる分子式がC4HBrで示される化合物には、シスートランス異性体を含め(5 or 6 ) 種類の構造が考えられる。
【旧センター試験化学】2018追試 第5問 問1 高分子化合物の構成元素

単元:
#化学#大学入試過去問(化学)#化学(高分子)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
3種類の元素でできている合成高分子化合物を、次の①~⑤のうちから一つ選べ。
① ナイロン 6
③ ポリアクリロニトリル
⑤ ポリプロピレン
② ブタジエンゴム
④ ポリスチレン
この動画を見る
3種類の元素でできている合成高分子化合物を、次の①~⑤のうちから一つ選べ。
① ナイロン 6
③ ポリアクリロニトリル
⑤ ポリプロピレン
② ブタジエンゴム
④ ポリスチレン
1分で解いてほしい化学計算問題 (65) メタンの燃焼

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#共通テスト#化学変化と化学反応式
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
メタンCH4を完全燃焼させたところ、18gの水H₂Oが生成した。このとき、生成した二酸化炭素CO2は何gか。最も適当な数値を、次の①~⑤ のうちから一つ選べ。(原子量H1C120 16)
① 9.0② 22 ③33 ④44 ⑤88
この動画を見る
メタンCH4を完全燃焼させたところ、18gの水H₂Oが生成した。このとき、生成した二酸化炭素CO2は何gか。最も適当な数値を、次の①~⑤ のうちから一つ選べ。(原子量H1C120 16)
① 9.0② 22 ③33 ④44 ⑤88
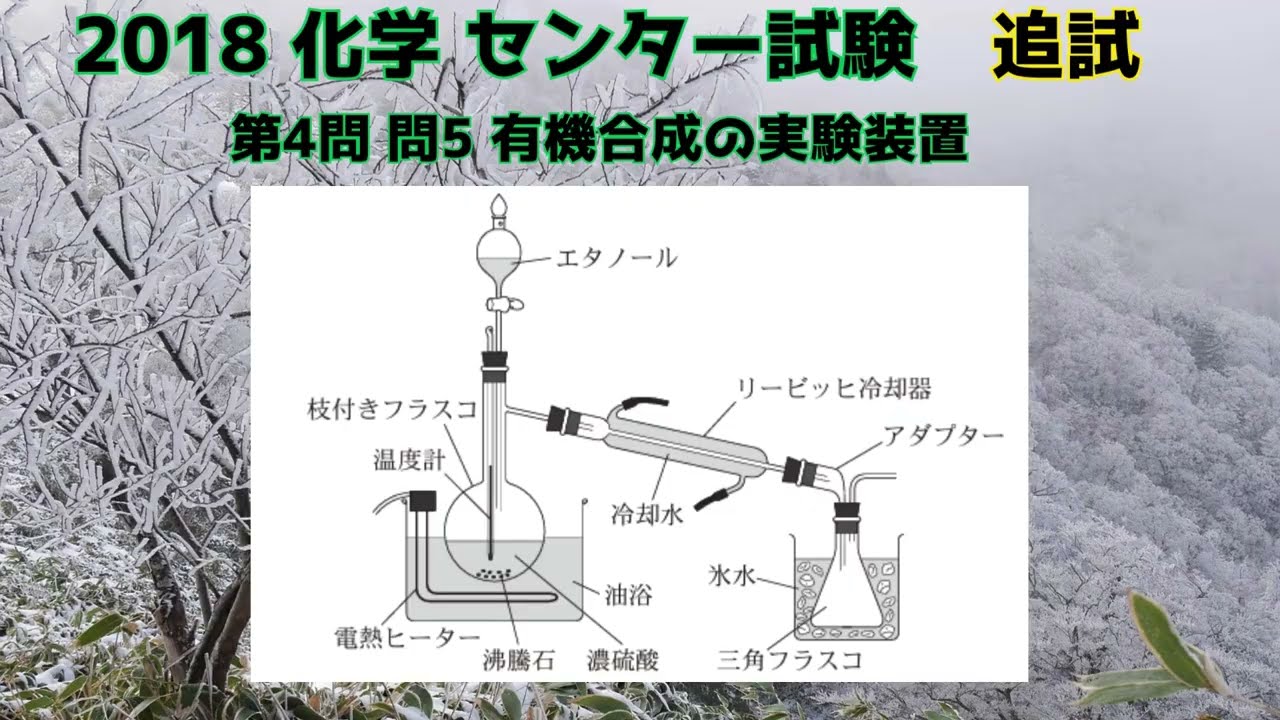
【旧センター試験化学】2018追試 第4問 問5 有機合成の実験装置
単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図1は、エタノールから化合物を合成するための実験装置である。枝付きフラスコに濃硫酸と沸騰石を入れ、ここにエタノールを滴下した後、混合物を油浴で約140℃に加熱したところ、化合物が氷水で冷やした三角フラスコに捕集された。この実験に関する記述として誤りを含むものを、下の①~⑤ のうちから一つ選べ。
①油脂を加熱するのにガスバーナーではなく電熱ヒーターを用いたのは、エタノールと化合物への引火を防ぐためである。
②フラスコ内の濃硫酸に沸騰石を入れたのは、突発的な沸騰を防ぐためである。
③リービッヒ冷却器には下から上に冷却水を流した。
④化合物Aは、同じ分子式をもつアルコールよりも沸点が高い。
⑤化合物Aは、エタノール2分子が総合してできた化合物である。
この動画を見る
図1は、エタノールから化合物を合成するための実験装置である。枝付きフラスコに濃硫酸と沸騰石を入れ、ここにエタノールを滴下した後、混合物を油浴で約140℃に加熱したところ、化合物が氷水で冷やした三角フラスコに捕集された。この実験に関する記述として誤りを含むものを、下の①~⑤ のうちから一つ選べ。
①油脂を加熱するのにガスバーナーではなく電熱ヒーターを用いたのは、エタノールと化合物への引火を防ぐためである。
②フラスコ内の濃硫酸に沸騰石を入れたのは、突発的な沸騰を防ぐためである。
③リービッヒ冷却器には下から上に冷却水を流した。
④化合物Aは、同じ分子式をもつアルコールよりも沸点が高い。
⑤化合物Aは、エタノール2分子が総合してできた化合物である。
【旧センター試験化学】2018追試 第4問 問4 油脂のヨウ素価

単元:
#化学#大学入試過去問(化学)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問4
油脂100gに付加するヨウ素の質量[g]の数値をヨウ素価という。次の油脂a~cについて,ヨウ素価が大きい順に並べたものはどれか。正しいものを,下の①~⑥のうちから一つ選べ。
a ステアリン酸C₁₇H₃₅COOHだけで構成されている油脂
b オレイン酸C₁₇H₃₃COOHだけで構成されている油脂
c リノール酸C₁₇H₃₁COOHとオレイン酸との二種類(物質比2:1)で構成されている油脂
①a>b>c
②a>c>b
③b>a>c
④b>c>a
⑤c>a>b
⑥c>b>a
この動画を見る
問4
油脂100gに付加するヨウ素の質量[g]の数値をヨウ素価という。次の油脂a~cについて,ヨウ素価が大きい順に並べたものはどれか。正しいものを,下の①~⑥のうちから一つ選べ。
a ステアリン酸C₁₇H₃₅COOHだけで構成されている油脂
b オレイン酸C₁₇H₃₃COOHだけで構成されている油脂
c リノール酸C₁₇H₃₁COOHとオレイン酸との二種類(物質比2:1)で構成されている油脂
①a>b>c
②a>c>b
③b>a>c
④b>c>a
⑤c>a>b
⑥c>b>a
無機化学基礎演習(14) アルミニウムの溶融塩電解
単元:
#化学#大学入試過去問(化学)#慶應義塾大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
C 12 Al 27 ファラデー定数:9.65×10⁴C/mol
※空欄にあてはまる数値を有効数字2桁で解答せよ。
氷晶石を高温で加熱して融解させたものに,純粋な酸化アルミニウムを溶かした後,炭酸電極を使って電気分解すると,陰極では単体のアルミニウムが得られる。
1.0×10⁵Aの電流で60時間電気分解したところ,陰極では(a)kgのアルミニウムが得られ,陽極では(b)kgの炭素が消費された。このとき,陽極で生成した一酸化炭素と二酸化炭素の物質量(mol)の比は5:1だった。
この動画を見る
C 12 Al 27 ファラデー定数:9.65×10⁴C/mol
※空欄にあてはまる数値を有効数字2桁で解答せよ。
氷晶石を高温で加熱して融解させたものに,純粋な酸化アルミニウムを溶かした後,炭酸電極を使って電気分解すると,陰極では単体のアルミニウムが得られる。
1.0×10⁵Aの電流で60時間電気分解したところ,陰極では(a)kgのアルミニウムが得られ,陽極では(b)kgの炭素が消費された。このとき,陽極で生成した一酸化炭素と二酸化炭素の物質量(mol)の比は5:1だった。
【旧センター試験化学】2018追試 第4問 問2 芳香族化合物C₇H₉Nの構造異性体の数

1分で解いてほしい化学計算問題 (64) 組成式から原子量を求める

単元:
#化学#大学入試過去問(化学)#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
金属元素Mの酸化物$M_{ 2 }O_{ 3 }$における構成元素の質量比がM:O=9:8のとき、Mの原子量を整数で答えよ。(Oの原子量16)
この動画を見る
金属元素Mの酸化物$M_{ 2 }O_{ 3 }$における構成元素の質量比がM:O=9:8のとき、Mの原子量を整数で答えよ。(Oの原子量16)
【旧センター試験化学】2018追試 第3問 問5 水素吸蔵合金

単元:
#化学#大学入試過去問(化学)#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
合金Мは、金属原子間に水素を水素原子として取り込むことのできる水素吸蔵合金であり、その単位格子は、チタンTi原子1個と鉄Fe原子1個からなるものとみなせる。208gの合金Mが3.2gの水素原子を吸蔵したとき、単位格子1個あたり平均何個の水素原子が合金Mに吸蔵されているか。最も適切な数値を、次の①~⑥のうちから一つ選べ。
①0.40
②0.50
③0.80
④1.0
⑤1.6
⑥2.0
この動画を見る
合金Мは、金属原子間に水素を水素原子として取り込むことのできる水素吸蔵合金であり、その単位格子は、チタンTi原子1個と鉄Fe原子1個からなるものとみなせる。208gの合金Mが3.2gの水素原子を吸蔵したとき、単位格子1個あたり平均何個の水素原子が合金Mに吸蔵されているか。最も適切な数値を、次の①~⑥のうちから一つ選べ。
①0.40
②0.50
③0.80
④1.0
⑤1.6
⑥2.0
無機化学基礎演習(13) 銀が王水に溶けない理由

単元:
#化学#大学入試過去問(化学)#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
金と異なり、銀は王水に入れてもほとんど溶解しない。その理由を50字以内で簡潔に記述せよ。
この動画を見る
金と異なり、銀は王水に入れてもほとんど溶解しない。その理由を50字以内で簡潔に記述せよ。
【旧センター試験化学】2018追試 第3問 問4 気体の発生

単元:
#化学#大学入試過去問(化学)#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図1は、固体Aと液体Bを混合することにより発生する気体を下方置換で捕集する装置である。この装置を使って気体を捕集するとき、反応させる固体Aと液体Bおよび発生する気体Cの組合せとして最も適当なものを、下の①~⑤のうちから一つ選べ。
図1および選択肢は動画参照
この動画を見る
図1は、固体Aと液体Bを混合することにより発生する気体を下方置換で捕集する装置である。この装置を使って気体を捕集するとき、反応させる固体Aと液体Bおよび発生する気体Cの組合せとして最も適当なものを、下の①~⑤のうちから一つ選べ。
図1および選択肢は動画参照
【旧センター試験化学】2018追試 第3問 問3 金属イオンの分離

単元:
#化学#大学入試過去問(化学)#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
2種類の金属イオンを含む水溶液に2種類の試薬を順に反応させて、金属イオンをそれぞれ沈殿として分離したい。含まれる金属イオンと加える試薬の組み合わせとして最も適当なものを、次の①~④のうちから一つ選べ。ただし、試薬は、それぞれの反応に十分な量を加えるとする。
表及び選択肢は動画参照
この動画を見る
2種類の金属イオンを含む水溶液に2種類の試薬を順に反応させて、金属イオンをそれぞれ沈殿として分離したい。含まれる金属イオンと加える試薬の組み合わせとして最も適当なものを、次の①~④のうちから一つ選べ。ただし、試薬は、それぞれの反応に十分な量を加えるとする。
表及び選択肢は動画参照
