 大学入試過去問(化学)
大学入試過去問(化学)
 大学入試過去問(化学)
大学入試過去問(化学)
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第4問 問4 異性体の数

単元:
#化学#有機#大学入試過去問(化学)#芳香族化合物#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
原子量$H1C 12 N 14 O 16$
次の操作Ⅰ・操作Ⅱからなる実験により、ベンゼンから有機化合物A(分子 量123)を合成した。
この実験および生成した化合物Aに関する記述として誤りを含むものを、下の①~⑤のうちから一つ選べ。
操作I 試験管に濃硫酸$2mL$と濃硝酸$2mL$を取り、
これにベンゼン$1mL$ を加えた後、試験管を振り混ぜながら$60℃$で十分な時間加熱した。
操作Ⅱ この試験管の内容物をすべてビーカー中の冷水$50mL$に注ぎ、ガラス棒でかき混ぜた後、静置した。
① 操作Ⅰでペンゼンを試験管に加えた直後、内容物は二層に分かれ、上層がベンゼンであった。
② 操作Ⅱの後、生成した化合物はビーカー内で上層に分離した。
③ 化合物は置換反応で生成した。
④ 化合物は特有のにおいをもつ。
⑤ 化合物はジエチルエーテルなどの有機溶媒によく溶ける。
この動画を見る
原子量$H1C 12 N 14 O 16$
次の操作Ⅰ・操作Ⅱからなる実験により、ベンゼンから有機化合物A(分子 量123)を合成した。
この実験および生成した化合物Aに関する記述として誤りを含むものを、下の①~⑤のうちから一つ選べ。
操作I 試験管に濃硫酸$2mL$と濃硝酸$2mL$を取り、
これにベンゼン$1mL$ を加えた後、試験管を振り混ぜながら$60℃$で十分な時間加熱した。
操作Ⅱ この試験管の内容物をすべてビーカー中の冷水$50mL$に注ぎ、ガラス棒でかき混ぜた後、静置した。
① 操作Ⅰでペンゼンを試験管に加えた直後、内容物は二層に分かれ、上層がベンゼンであった。
② 操作Ⅱの後、生成した化合物はビーカー内で上層に分離した。
③ 化合物は置換反応で生成した。
④ 化合物は特有のにおいをもつ。
⑤ 化合物はジエチルエーテルなどの有機溶媒によく溶ける。
5年連続的中!共通テスト2024出題予想~問題流出同然の「今年はコレが出る」一覧

単元:
#大学入試過去問(数学)#化学#生物#センター試験・共通テスト関連#共通テスト#大学入試過去問(化学)#英語(高校生)#国語(高校生)#社会(高校生)#日本史#世界史#大学入試過去問(英語)#大学入試過去問(国語)#共通テスト#共通テスト(現代文)#大学入試過去問(生物)#共通テスト・センター試験#共通テスト(古文)#共通テスト#大学入試過去問・共通テスト・模試関連#大学入試過去問・共通テスト・模試関連#数学(高校生)#理科(高校生)
指導講師:
篠原好【京大模試全国一位の勉強法】
問題文全文(内容文):
共通テスト2024の出題予想です。
この動画では私、篠原が過去の問題の傾向から、2024年の共通テストの問題を予想します。
英語・数学・国語・理科・社会に分けて、出題予想、対策方法を紹介しています。
受験生のみなさん、合格目指してラストスパート頑張りましょう!
#共通テスト
#出題予想
#受験生
#共通テスト2024予想
#篠原好
#京都大学
#勉強法
#大学受験
#受験勉強
#大学入試
この動画を見る
共通テスト2024の出題予想です。
この動画では私、篠原が過去の問題の傾向から、2024年の共通テストの問題を予想します。
英語・数学・国語・理科・社会に分けて、出題予想、対策方法を紹介しています。
受験生のみなさん、合格目指してラストスパート頑張りましょう!
#共通テスト
#出題予想
#受験生
#共通テスト2024予想
#篠原好
#京都大学
#勉強法
#大学受験
#受験勉強
#大学入試
1分で解いてほしい化学計算問題 (34) メタンの燃料電池

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
〔2023年 神戸学院大学〕
次の図は、メタンを原料として用いた燃料電池の模式図である。この燃料電池を 放電して、$4.0A$の電流を秒間流すために必要なメタンの物質量は何$mol $か。
ただし、この燃料電池の両極で起こる化学反応は、次の式で示されるものと し、メタンはすべてこの反応で消費されるものとする。
(ファラデー定数:$9.65 \times 10^4C/mol$)
負極:$CH_4+2H_2O →CO_2+8H^{+}+8e^{-}$
正極:$O_2+4H^{+}+4e^{-} →2H_2O$
この動画を見る
〔2023年 神戸学院大学〕
次の図は、メタンを原料として用いた燃料電池の模式図である。この燃料電池を 放電して、$4.0A$の電流を秒間流すために必要なメタンの物質量は何$mol $か。
ただし、この燃料電池の両極で起こる化学反応は、次の式で示されるものと し、メタンはすべてこの反応で消費されるものとする。
(ファラデー定数:$9.65 \times 10^4C/mol$)
負極:$CH_4+2H_2O →CO_2+8H^{+}+8e^{-}$
正極:$O_2+4H^{+}+4e^{-} →2H_2O$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第4問 問4 異性体の数

単元:
#化学#有機#大学入試過去問(化学)#酸素を含む脂肪族化合物#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
有機化合物の異性体に関する次の問い(a・b)に答えよ。
a 分子式 $CHO_2$で表される化合物のうち、エステル結合をもつものはいくつ存在するか。
正しい数を、次の①~⑥のうちから一つ選べ。
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$ ⑥$6$
b 分子式 $C_7H_7CI$で表される化合物のうち、ベンゼン環をもつものはいくつ存在するか。
正しい数を、次の①~⑥のうちから一つ選べ。
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$ ⑥$6$
この動画を見る
有機化合物の異性体に関する次の問い(a・b)に答えよ。
a 分子式 $CHO_2$で表される化合物のうち、エステル結合をもつものはいくつ存在するか。
正しい数を、次の①~⑥のうちから一つ選べ。
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$ ⑥$6$
b 分子式 $C_7H_7CI$で表される化合物のうち、ベンゼン環をもつものはいくつ存在するか。
正しい数を、次の①~⑥のうちから一つ選べ。
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$ ⑥$6$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第4問 問3 元素分析

単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
原子量$H1 C 12 O 16 S 32$
炭素,水素、酸素、硫黄からなる有機化合物の元素分析を行ったところ、炭素、水素、硫黄の質量パーセントが表1のようになった。
この有機化合物の組成式として最も適当なものを、下の①~⑥のうちから一つ選べ。
①$CH_4OS$
②$C_2H_6OS$
③$C_2H_6O_2S$
④$C_3H_8OS$
⑤$C_3H_8O_2S$
⑥$C_3H_80_2S_2$
※表は動画内参照
この動画を見る
原子量$H1 C 12 O 16 S 32$
炭素,水素、酸素、硫黄からなる有機化合物の元素分析を行ったところ、炭素、水素、硫黄の質量パーセントが表1のようになった。
この有機化合物の組成式として最も適当なものを、下の①~⑥のうちから一つ選べ。
①$CH_4OS$
②$C_2H_6OS$
③$C_2H_6O_2S$
④$C_3H_8OS$
⑤$C_3H_8O_2S$
⑥$C_3H_80_2S_2$
※表は動画内参照
【解答速報・全問解説】2024年 神奈川大学給費生試験 化学 解答速報【ケミストリー・アイバ】

単元:
#化学#大学入試過去問(化学)#理科(高校生)#神奈川大学#大学入試解答速報#化学#神奈川大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
こちらの動画は、2023年12月17日(日)に実施された、2024年神奈川大学給費生試験の化学の解答速報です。
当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
解説者は理数個別指導学院中山校のケミストリー・アイバ先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr7jp7xWZdgXXBKBWKpX-BRp
この動画を見る
こちらの動画は、2023年12月17日(日)に実施された、2024年神奈川大学給費生試験の化学の解答速報です。
当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
著作権の関係で問題を映せないため、お手元に問題をご用意した上でご覧ください。
解説者は理数個別指導学院中山校のケミストリー・アイバ先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr7jp7xWZdgXXBKBWKpX-BRp
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第4問 問1 エタノールの性質

単元:
#化学#有機#大学入試過去問(化学)#酸素を含む脂肪族化合物#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
エタノールに関する記述として誤りを含むものを、次の①~⑥のうちから一 つ選べ。
① 糖類の発酵によって得ることができる。
② 水と任意の割合で溶け合う。
③ ナトリウムと反応させると、水素が発生する。
④ 硫酸酸性のニクロム酸カリウムで酸化すると、
アセトアルデヒドが生成する。
⑤ ヨウ素および水酸化ナトリウム水溶液を加えて加熱すると、黄色沈殿が生成する。
⑥ フェーリング液を加えて加熱すると、赤色の酸化銅(I)が析出する。
この動画を見る
エタノールに関する記述として誤りを含むものを、次の①~⑥のうちから一 つ選べ。
① 糖類の発酵によって得ることができる。
② 水と任意の割合で溶け合う。
③ ナトリウムと反応させると、水素が発生する。
④ 硫酸酸性のニクロム酸カリウムで酸化すると、
アセトアルデヒドが生成する。
⑤ ヨウ素および水酸化ナトリウム水溶液を加えて加熱すると、黄色沈殿が生成する。
⑥ フェーリング液を加えて加熱すると、赤色の酸化銅(I)が析出する。
2024年神奈川大学給費生入試解答速報について+過去問から分かる英語の裏技紹介
単元:
#化学#大学入試過去問(化学)#英語(高校生)#大学入試過去問(英語)#学校別大学入試過去問解説(英語)#理科(高校生)#神奈川大学#神奈川大学#大学入試解答速報#数学#神奈川大学#英語#神奈川大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
2023年12月17日(日)に神奈川大学給費生試験を受ける生徒諸君へ朗報!!
この動画を見る
2023年12月17日(日)に神奈川大学給費生試験を受ける生徒諸君へ朗報!!
【聖マリアンナ医科大学】令和5年度一般選抜試験(前期) 天然高分子化合物 過去問解説!(後半)

単元:
#化学#大学入試過去問(化学)#化学(高分子)#合成繊維と天然繊維#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
等電点をもつ分子はどれか。
ア)$H_2N(CH_2)_2COOH$
イ)$C_6H_5NH_2$
ウ)$HSCH_2CH(NH_2)COOH$
エ)$CH_3SCH_2CH_2CH(NH_2)COOH$
オ)$C_6H_5CH_2CH(NH_2)COOH$
カ)$CH_3CH(OH)COOH$
キ)$(C_{17}H_{33}COO)_3C_3H_5$
ニンヒドリン反応をする分子はどれか。
ア)$H_2N(CH_2)_2COOH$
イ)$C_6H_5NH_2$
ウ)$HSCH_2CH(NH_2)COOH$
エ)$CH_3SCH_2CH_2CH(NH_2)COOH$
オ)$C_6H_5CH_2CH(NH_2)COOH$
カ)$CH_3CH(OH)COOH$
キ)$(C_{17}H_{33}COO)_3C_3H_5$
タンパク質の一次構造を15字以内で説明せよ。
解答例:ペプチドのアミノ酸配列
タンパク質の二次構造に見られず、三次構造で見られる共有 結合の名称と、この結合をする分子を2つ選べ。同じものを2回選んでもよい。
ア)$H_2N(CH_2)_2COOH$
イ)$C_6H_5NH_2$
ウ)$HSCH_2CH(NH_2)COOH$
エ)$CH_3SCH_2CH_2CH(NH_2)COOH$
オ)$C_6H_5CH_2CH(NH_2)COOH$
カ)$CH_3CH(OH)COOH$
キ)$(C_{17}H_{33}COO)_3C_3H_5$
油脂を選べ。
また、この油脂のけん化価(油脂$1g$を完全に加水分解するために必要な$KOH$の質量[mg])を有効数字2桁で求めなさい。
(原子量 $H 1 C 12 O 16 K 39$)
この油脂$1mol$の$C=C$すべてに水素を付加させるとき、何$mol$ の水素が必要か自然数で求めよ。
この動画を見る
等電点をもつ分子はどれか。
ア)$H_2N(CH_2)_2COOH$
イ)$C_6H_5NH_2$
ウ)$HSCH_2CH(NH_2)COOH$
エ)$CH_3SCH_2CH_2CH(NH_2)COOH$
オ)$C_6H_5CH_2CH(NH_2)COOH$
カ)$CH_3CH(OH)COOH$
キ)$(C_{17}H_{33}COO)_3C_3H_5$
ニンヒドリン反応をする分子はどれか。
ア)$H_2N(CH_2)_2COOH$
イ)$C_6H_5NH_2$
ウ)$HSCH_2CH(NH_2)COOH$
エ)$CH_3SCH_2CH_2CH(NH_2)COOH$
オ)$C_6H_5CH_2CH(NH_2)COOH$
カ)$CH_3CH(OH)COOH$
キ)$(C_{17}H_{33}COO)_3C_3H_5$
タンパク質の一次構造を15字以内で説明せよ。
解答例:ペプチドのアミノ酸配列
タンパク質の二次構造に見られず、三次構造で見られる共有 結合の名称と、この結合をする分子を2つ選べ。同じものを2回選んでもよい。
ア)$H_2N(CH_2)_2COOH$
イ)$C_6H_5NH_2$
ウ)$HSCH_2CH(NH_2)COOH$
エ)$CH_3SCH_2CH_2CH(NH_2)COOH$
オ)$C_6H_5CH_2CH(NH_2)COOH$
カ)$CH_3CH(OH)COOH$
キ)$(C_{17}H_{33}COO)_3C_3H_5$
油脂を選べ。
また、この油脂のけん化価(油脂$1g$を完全に加水分解するために必要な$KOH$の質量[mg])を有効数字2桁で求めなさい。
(原子量 $H 1 C 12 O 16 K 39$)
この油脂$1mol$の$C=C$すべてに水素を付加させるとき、何$mol$ の水素が必要か自然数で求めよ。
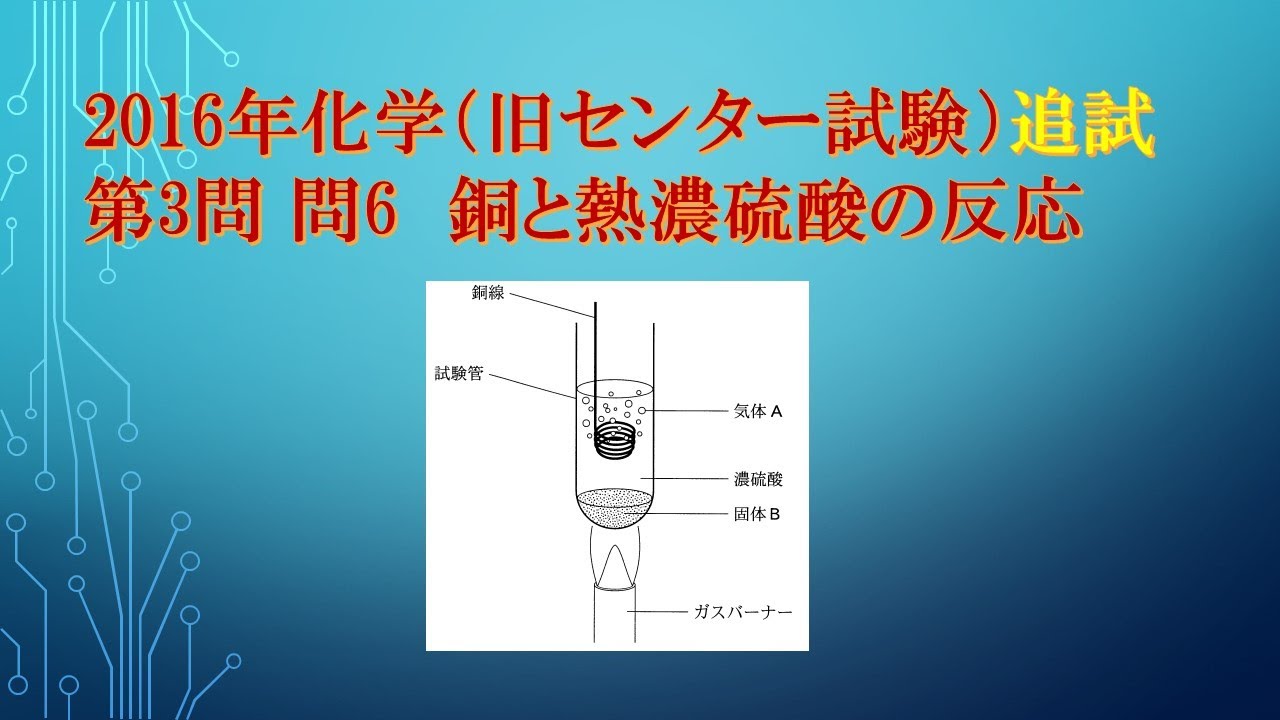
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第3問 問6 銅と熱濃硫酸の反応
単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#共通テスト#酸化還元反応#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図1に示すように、試験管に濃硫酸を入れて加熱しながら、そこに銅線を注意深く浸したところ、刺激臭のある気体$A$が発生した。
濃硫酸は徐々に着色し、しばらくすると試験管の底に白色の固体$B$が沈殿した。
固体$B$を取り出し水に溶かすと、その溶液は青色となった。
この実験で発生した気体と生成した固体$B$に関する記述として誤りを含むものを、下の①~⑤のうちから一つ選べ。
① 気体$A$は、下方置換で捕集できる。
② 硫化水素の水溶液に気体$A$を通じると、硫黄が析出する。
③ ヨウ素を溶かしたヨウ化カリウム水溶液に気体$A$を通じると、ヨウ素の色が消える。
④ 気体$A$を水に溶かした水溶液は、中性を示す。
⑤ 固体$$Bは、硫酸銅(II)の無水物(無水塩)である。
※図は動画内参照
この動画を見る
図1に示すように、試験管に濃硫酸を入れて加熱しながら、そこに銅線を注意深く浸したところ、刺激臭のある気体$A$が発生した。
濃硫酸は徐々に着色し、しばらくすると試験管の底に白色の固体$B$が沈殿した。
固体$B$を取り出し水に溶かすと、その溶液は青色となった。
この実験で発生した気体と生成した固体$B$に関する記述として誤りを含むものを、下の①~⑤のうちから一つ選べ。
① 気体$A$は、下方置換で捕集できる。
② 硫化水素の水溶液に気体$A$を通じると、硫黄が析出する。
③ ヨウ素を溶かしたヨウ化カリウム水溶液に気体$A$を通じると、ヨウ素の色が消える。
④ 気体$A$を水に溶かした水溶液は、中性を示す。
⑤ 固体$$Bは、硫酸銅(II)の無水物(無水塩)である。
※図は動画内参照
【聖マリアンナ医科大学】令和5年度一般選抜試験(前期) 天然高分子化合物 過去問解説!(前半)

単元:
#化学#大学入試過去問(化学)#化学(高分子)#アミノ酸とタンパク質、核酸#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[1]1) 問題概要
①・②の官能基の名称を答え、構造式を書きなさい。
③の構造の名称を答え、構造式を書きなさい。
(価標省略不可)
[1]2) 問題概要 $H 1.00 C 12.0 N 14.0 Ο 16.0$
グリシルアラニンの分子量を自然数で求めよ。
ただし、電離 はしていないものとする
[1]2) 問題概要
アラニン1分子と2分子からなるトリペプチドは 鏡像異性体を含めて何種類異性体があるか。
[1]3) 問題概要
アラニン1分子と2分子からなるトリペプチドは 鏡像異性体を含めて何種類異性体があるか。
$H_2N- \boxed{ Gly } \boxed{ Gly } \boxed{ Ala } - COOH$
並べ方はアラニンをどこに置くかで3通り
更にアラニンは鏡像異性体をもつため2種類ある
3× 2 = 6種類
※構造式は動画内参照
この動画を見る
[1]1) 問題概要
①・②の官能基の名称を答え、構造式を書きなさい。
③の構造の名称を答え、構造式を書きなさい。
(価標省略不可)
[1]2) 問題概要 $H 1.00 C 12.0 N 14.0 Ο 16.0$
グリシルアラニンの分子量を自然数で求めよ。
ただし、電離 はしていないものとする
[1]2) 問題概要
アラニン1分子と2分子からなるトリペプチドは 鏡像異性体を含めて何種類異性体があるか。
[1]3) 問題概要
アラニン1分子と2分子からなるトリペプチドは 鏡像異性体を含めて何種類異性体があるか。
$H_2N- \boxed{ Gly } \boxed{ Gly } \boxed{ Ala } - COOH$
並べ方はアラニンをどこに置くかで3通り
更にアラニンは鏡像異性体をもつため2種類ある
3× 2 = 6種類
※構造式は動画内参照
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第3問 問5 硫酸鉄(Ⅲ)のモル濃度

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#物質量と濃度#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
濃度不明の硫酸鉄(Ⅲ) $Fe_2(SO_4)_3$、水溶液の濃度を求めるために、次の実験Ⅰおよび実験Ⅱを行った。
ただし、この溶液には硫酸鉄(Ⅲ)のみが溶質として含まれているとする。
実験Ⅰ この溶液$20ml$ をピーカーに採取し、濃アンモニア水を徐々に加えると沈殿が生成した。
さらに濃アンモニア水を加え、新たに沈殿が生じないことを確認した。
実験Ⅱ 実験Ⅰで生成した沈殿をすべて回収し、十分洗浄した後、耐熱性の容器に入れて空気中で$600℃$までゆっくり加熱した。
最終的に$160mg$の純粋な酸化鉄(Ⅲ)が得られた。
もとの溶液中の硫酸鉄(Ⅲ)の濃度は何$mol/L$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
①$0.0050$
②$0.010$
③$0.020$
④$0.050$
⑤$0.10$
⑥$0.20$
この動画を見る
濃度不明の硫酸鉄(Ⅲ) $Fe_2(SO_4)_3$、水溶液の濃度を求めるために、次の実験Ⅰおよび実験Ⅱを行った。
ただし、この溶液には硫酸鉄(Ⅲ)のみが溶質として含まれているとする。
実験Ⅰ この溶液$20ml$ をピーカーに採取し、濃アンモニア水を徐々に加えると沈殿が生成した。
さらに濃アンモニア水を加え、新たに沈殿が生じないことを確認した。
実験Ⅱ 実験Ⅰで生成した沈殿をすべて回収し、十分洗浄した後、耐熱性の容器に入れて空気中で$600℃$までゆっくり加熱した。
最終的に$160mg$の純粋な酸化鉄(Ⅲ)が得られた。
もとの溶液中の硫酸鉄(Ⅲ)の濃度は何$mol/L$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
①$0.0050$
②$0.010$
③$0.020$
④$0.050$
⑤$0.10$
⑥$0.20$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第3問 問4 金属イオンの反応

単元:
#化学#無機#大学入試過去問(化学)#共通テスト#典型金属元素の単体と化合物#遷移元素の単体と化合物#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
次のアおよびイの3種類のイオンを含む各水溶液から、下線を引いたイオンのみを沈殿として分離したい。
最も適当な方法を、下の①~④のうちから一つずつ選べ。
ただし、同じものを選んでもよい。
ア $Pb^{2+},Fe^{2+}, Ca^{2+}$
イ $Cu^{2+},Pb^{2+},Al^{3+}$
① 水酸化ナトリウム水溶液を過剰に加える。
②アンモニア水を過剰に加える。
③ 室温で希塩酸を加える。
④ アンモニア水を加えて塩基性にしたのち、硫化水素を通じる。
この動画を見る
次のアおよびイの3種類のイオンを含む各水溶液から、下線を引いたイオンのみを沈殿として分離したい。
最も適当な方法を、下の①~④のうちから一つずつ選べ。
ただし、同じものを選んでもよい。
ア $Pb^{2+},Fe^{2+}, Ca^{2+}$
イ $Cu^{2+},Pb^{2+},Al^{3+}$
① 水酸化ナトリウム水溶液を過剰に加える。
②アンモニア水を過剰に加える。
③ 室温で希塩酸を加える。
④ アンモニア水を加えて塩基性にしたのち、硫化水素を通じる。
【星薬科大学】2023年度化学 一般選抜B方式 天然高分子化合物 過去問解説!

単元:
#化学#大学入試過去問(化学)#化学(高分子)#合成繊維と天然繊維#理科(高校生)#星薬科大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
分子量$828$の$8.28g$を加水分解して得たグルコース全量から$400mL$のグルコース水溶液を調製すると、そのモル濃度は何$mol/L$になるか。
ポリ乳酸が該当するものとして、最も適当なものを選べ。
1.レーヨン
2.アクリル繊維
3.ユリア樹脂
4.ビニロン
5.ポリスチレン
6.ポリエステル
7.ポリアミド
8.アセテート
ア:分子量$7434$のポリ乳酸$100g$が微生物に分解されて生じ た二酸化炭素の体積〔L〕を求めよ。
イ:その二酸化炭素がすべて光合成によってグルコースに変
換された場合の質量 〔g〕を求めよ。
この動画を見る
分子量$828$の$8.28g$を加水分解して得たグルコース全量から$400mL$のグルコース水溶液を調製すると、そのモル濃度は何$mol/L$になるか。
ポリ乳酸が該当するものとして、最も適当なものを選べ。
1.レーヨン
2.アクリル繊維
3.ユリア樹脂
4.ビニロン
5.ポリスチレン
6.ポリエステル
7.ポリアミド
8.アセテート
ア:分子量$7434$のポリ乳酸$100g$が微生物に分解されて生じ た二酸化炭素の体積〔L〕を求めよ。
イ:その二酸化炭素がすべて光合成によってグルコースに変
換された場合の質量 〔g〕を求めよ。
戦う準備はできているか。共通テストまで残り40日

単元:
#化学#生物#情報Ⅰ(高校生)#センター試験・共通テスト関連#共通テスト#英語(高校生)#国語(高校生)#社会(高校生)#世界史#共通テスト#共通テスト(現代文)#共通テスト・センター試験#共通テスト(古文)#共通テスト#大学入試過去問・共通テスト・模試関連#大学入試過去問・共通テスト・模試関連#数学(高校生)#理科(高校生)#数学#共通テスト#英語#化学#物理#共通テスト#共通テスト#共通テスト#共通テスト#【河合塾】全統共通テスト模試
指導講師:
カサニマロ【べんとう・ふきのとうの授業動画】
問題文全文(内容文):
共通テストまで40日。点数アップのための方法解説動画です
この動画を見る
共通テストまで40日。点数アップのための方法解説動画です
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第3問 問3 金属の性質と利用

単元:
#化学#無機#大学入試過去問(化学)#共通テスト#典型金属元素の単体と化合物#遷移元素の単体と化合物#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
金属元素に関する記述として下線部に誤りを含むものを、
次の①~⑤のうちから一つ選べ。
①アルミニウムの単体は$AI^{3+}$を含む水溶液の電気分解により得られる。
② $AgCl$や $AgBr$ に光が当たると分解し $Ag$が析出する現象は、写真のフィ ルムなどに利用される。
③ 白金やニッケルは、触媒として利用されている。
④ 鉛は、放射線の遮蔽材として利用されている。
⑤ マグネシウムの単体は、空気中で強熱すると明るい光を発して燃焼し、酸化マグネシウムを生じる。
この動画を見る
金属元素に関する記述として下線部に誤りを含むものを、
次の①~⑤のうちから一つ選べ。
①アルミニウムの単体は$AI^{3+}$を含む水溶液の電気分解により得られる。
② $AgCl$や $AgBr$ に光が当たると分解し $Ag$が析出する現象は、写真のフィ ルムなどに利用される。
③ 白金やニッケルは、触媒として利用されている。
④ 鉛は、放射線の遮蔽材として利用されている。
⑤ マグネシウムの単体は、空気中で強熱すると明るい光を発して燃焼し、酸化マグネシウムを生じる。
【12月勉強】この優先順位で勉強すると伸びます。

単元:
#大学入試過去問(数学)#物理#化学#生物#センター試験・共通テスト関連#共通テスト#その他#大学入試過去問(物理)#大学入試過去問(化学)#英語(高校生)#国語(高校生)#社会(高校生)#日本史#世界史#勉強法・その他#大学入試過去問(英語)#大学入試過去問(国語)#共通テスト#共通テスト(現代文)#勉強法#勉強法#その他#大学入試過去問(生物)#共通テスト・センター試験#共通テスト(古文)#共通テスト#勉強法#大学入試過去問・共通テスト・模試関連#大学入試過去問・共通テスト・模試関連#数学(高校生)#理科(高校生)#大学入試解答速報#数学#共通テスト#英語#化学#物理#共通テスト#共通テスト#共通テスト#共通テスト#世界史#共通テスト
指導講師:
カサニマロ【べんとう・ふきのとうの授業動画】
問題文全文(内容文):
12月の勉強法 優先順位説明動画です
この動画を見る
12月の勉強法 優先順位説明動画です
【日本最速解答速報】2024年星薬科大学薬学部薬学科(6年制) 学校推薦型選抜 化学 解答速報【化学のタカシー】

単元:
#化学#大学入試過去問(化学)#理科(高校生)#大学入試解答速報#化学#星薬科大学#星薬科大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
こちらの動画は、2023年11月26日(日)に実施された、2024年星薬科大学薬学部薬学科(6年制)学校推薦型選抜の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院宮崎台校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
この動画を見る
こちらの動画は、2023年11月26日(日)に実施された、2024年星薬科大学薬学部薬学科(6年制)学校推薦型選抜の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院宮崎台校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第3問 問1 無機化学の知識問題

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
身のまわりにある元素の単体と化合物に関する記述として下線部に誤りを含 むものを、次の①~⑤のうちから一つ選べ。
① 酸化カルシウムは、水と反応して発熱するため、
携帯用の加熱剤に用いられる。
② 酸化アルミニウムは、ルビーやサファイアの主成分である。
③ 酸化チタン(IV)は、光触媒としての性質をもつため、有機物の汚れなどを分解するために利用される。
④ ヘリウムは、常温で水素についで密度が小さく、飛行船の浮揚ガスに用いられる。
⑤ 金は、化学的に非常に安定であるが、熱濃硫酸には溶ける。
この動画を見る
身のまわりにある元素の単体と化合物に関する記述として下線部に誤りを含 むものを、次の①~⑤のうちから一つ選べ。
① 酸化カルシウムは、水と反応して発熱するため、
携帯用の加熱剤に用いられる。
② 酸化アルミニウムは、ルビーやサファイアの主成分である。
③ 酸化チタン(IV)は、光触媒としての性質をもつため、有機物の汚れなどを分解するために利用される。
④ ヘリウムは、常温で水素についで密度が小さく、飛行船の浮揚ガスに用いられる。
⑤ 金は、化学的に非常に安定であるが、熱濃硫酸には溶ける。
【日本最速解答速報】2024年明治薬科大学薬学部薬学科(6年制)公募制推薦 化学解答速報+かなり丁寧に詳細解説 後編(問11~問23)【化学のタカシー】

単元:
#化学#大学入試過去問(化学)#理科(高校生)#大学入試解答速報#化学#明治薬科大学#明治薬科大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
前編はこちら
https://youtu.be/BfcxjA1O-qQ
こちらの動画は、2023年11月18日(土)に実施された、2024年明治薬科大学薬学部薬学科(6年制)公募制推薦の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院宮崎校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
この動画を見る
前編はこちら
https://youtu.be/BfcxjA1O-qQ
こちらの動画は、2023年11月18日(土)に実施された、2024年明治薬科大学薬学部薬学科(6年制)公募制推薦の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院宮崎校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
【日本最速解答速報】2024年明治薬科大学薬学部薬学科(6年制)公募制推薦 化学解答速報+かなり丁寧に詳細解説 前編(問1~問10)【化学のタカシー】

単元:
#化学#大学入試過去問(化学)#理科(高校生)#大学入試解答速報#化学#明治薬科大学#明治薬科大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
後編はこちら
https://youtu.be/1AiASKTCXNQ
こちらの動画は、2023年11月18日(土)に実施された、2024年明治薬科大学薬学部薬学科(6年制)公募制推薦の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院宮崎校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
この動画を見る
後編はこちら
https://youtu.be/1AiASKTCXNQ
こちらの動画は、2023年11月18日(土)に実施された、2024年明治薬科大学薬学部薬学科(6年制)公募制推薦の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院宮崎校の化学のタカシー先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr5qi7Un9JtVHCpSK5u3W5lZ
【日本最速解答速報】2024年昭和薬科大学公募制・学校推薦型選抜 化学解答速報 【ケミストリー・アイバ】

単元:
#化学#大学入試過去問(化学)#理科(高校生)#大学入試解答速報#化学#昭和薬科大学#昭和薬科大学
指導講師:
理数個別チャンネル
問題文全文(内容文):
こちらの動画は、2023年11月19日(日)に実施された、2024年昭和薬科大学公募制・学校推薦型選抜の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院中山校のケミストリー・アイバ先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr7jp7xWZdgXXBKBWKpX-BRp
この動画を見る
こちらの動画は、2023年11月19日(日)に実施された、2024年昭和薬科大学公募制・学校推薦型選抜の化学解答速報です。
大学の正解発表ではなく、あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
解説者は理数個別指導学院中山校のケミストリー・アイバ先生です。
https://www.youtube.com/playlist?list=PLdLgDY469Qr7jp7xWZdgXXBKBWKpX-BRp
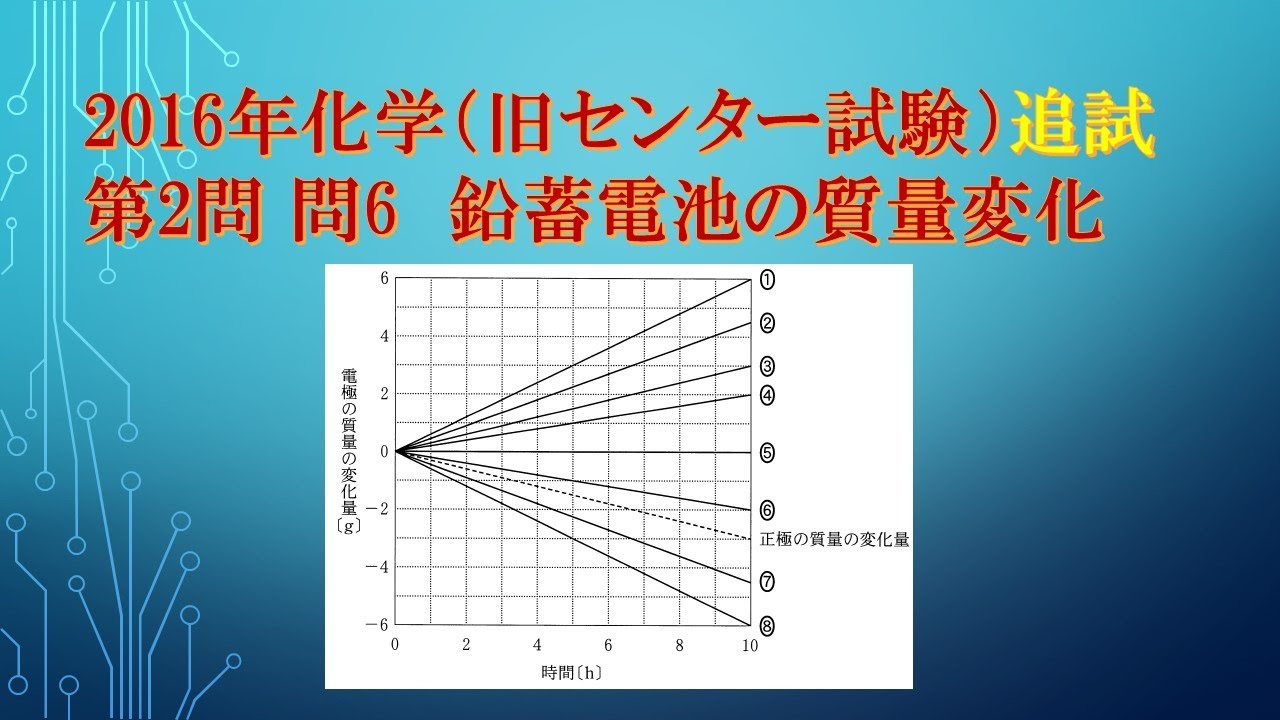
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問6 鉛蓄電池
単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
鉛蓄電池に関する次の問い(a・b)に答えよ。
次の文章中のア~ウに当てはまる語句と数値の組合せとして 正しいものを、下の①~⑥のうちから一つ選べ。
鉛蓄電池の放電時には正極で$PbO_2$が$PbSO_4$になる
$\boxed{ ア }$ 反応が起こり、負極で$Pb$が$PbSO_4$になる
$\boxed{ イ }$ 反応が起こる。
正極で$1mol$の $PbSO_4$が生成するとき、 $\boxed{ ウ } mol$の電子が流れる。
※表は動画内参照
この動画を見る
鉛蓄電池に関する次の問い(a・b)に答えよ。
次の文章中のア~ウに当てはまる語句と数値の組合せとして 正しいものを、下の①~⑥のうちから一つ選べ。
鉛蓄電池の放電時には正極で$PbO_2$が$PbSO_4$になる
$\boxed{ ア }$ 反応が起こり、負極で$Pb$が$PbSO_4$になる
$\boxed{ イ }$ 反応が起こる。
正極で$1mol$の $PbSO_4$が生成するとき、 $\boxed{ ウ } mol$の電子が流れる。
※表は動画内参照
【共通テスト】物理・化学をどうにかしたい人へ_この動画でなんとかします。

単元:
#物理#化学#大学入試過去問(物理)#大学入試過去問(化学)#共通テスト#理科(高校生)#大学入試解答速報#化学#物理#共通テスト#共通テスト
指導講師:
カサニマロ【べんとう・ふきのとうの授業動画】
問題文全文(内容文):
【共通テスト】物理・化学勉強法解説動画です
この動画を見る
【共通テスト】物理・化学勉強法解説動画です
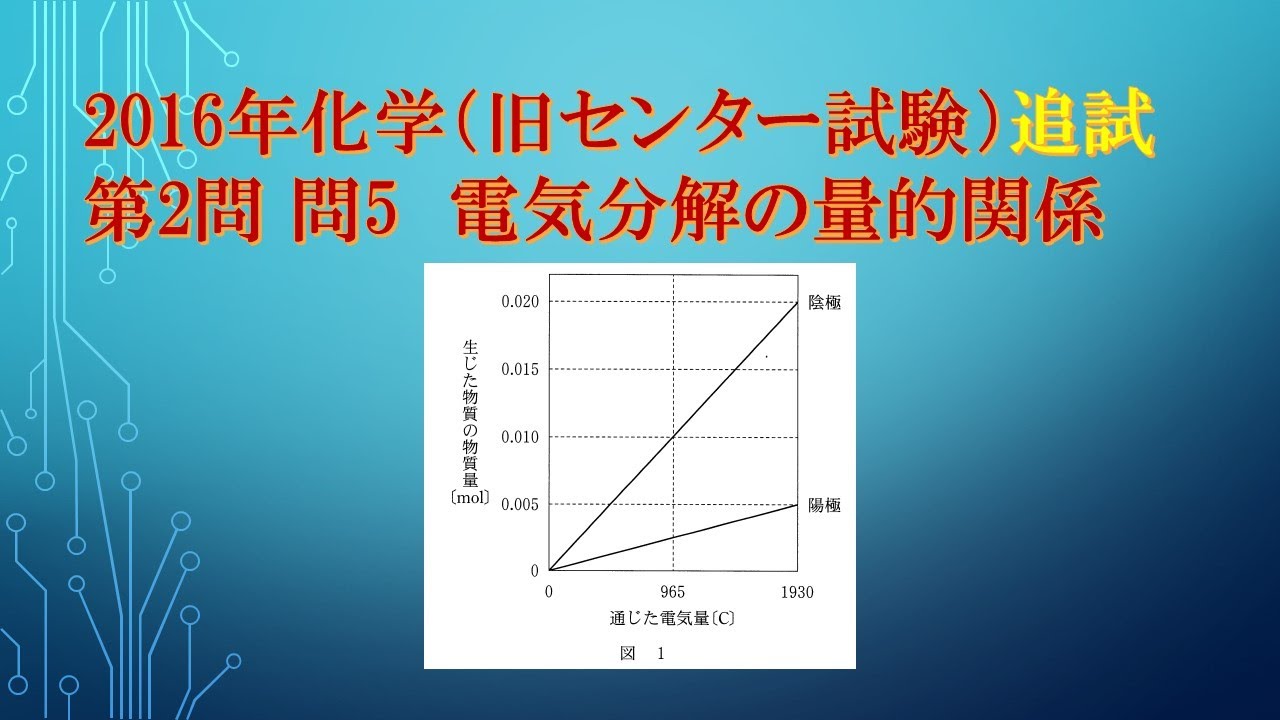
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問6 電気分解の量的関係
単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ある電解質$A$の水溶液を、白金電極を用いて電気分解したところ、通じた電気量と両極で生じた物質の物質量との関係が図のようになった。
電解質$A$として最も適当なものを、下の①~⑤のうちから一つ選べ。
①$NaCH$
②$Na_2SO_4$
③$KCI$
④$CuCI_2$
⑤$AgNO_3$
※図は動画内参照
この動画を見る
ある電解質$A$の水溶液を、白金電極を用いて電気分解したところ、通じた電気量と両極で生じた物質の物質量との関係が図のようになった。
電解質$A$として最も適当なものを、下の①~⑤のうちから一つ選べ。
①$NaCH$
②$Na_2SO_4$
③$KCI$
④$CuCI_2$
⑤$AgNO_3$
※図は動画内参照
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問6 電気分解の量的関係

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ある電解質Aの水溶液を、白金電極を用いて電気分解したところ、通じた電気量と両極で生じた物質の物質量との関係が図1のようになった。
電解質Aとして最も適当なものを、下の①~⑤のうちから一つ選べ。
①$NaOH$
②$NA_2SO_4$
③$KCI$
④$CuCI_2$
⑤$AgNO_3$
※図は動画内参照
この動画を見る
ある電解質Aの水溶液を、白金電極を用いて電気分解したところ、通じた電気量と両極で生じた物質の物質量との関係が図1のようになった。
電解質Aとして最も適当なものを、下の①~⑤のうちから一つ選べ。
①$NaOH$
②$NA_2SO_4$
③$KCI$
④$CuCI_2$
⑤$AgNO_3$
※図は動画内参照
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問4 中和反応後のpH

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#酸と塩基・水素イオン濃度#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
濃度不明の塩酸$1.0L$を$0.030mol/L$の水酸化ナトリウム水溶液$1.0L$と混合したところ、$0.56kJ$の発熱があった。
この混合溶液の$pH$として最も適当な数値を①~⑧のうちから一つ選べ。
ただし、中和熱は$56kJ/mol$とし、中和反応以外による発熱または吸熱は無視できるものとする。
①$1$ ②$2$ ③$3$ ④$5$ ⑤$9$ ⑥$11$ ⑦$12$ ⑧$13$
この動画を見る
濃度不明の塩酸$1.0L$を$0.030mol/L$の水酸化ナトリウム水溶液$1.0L$と混合したところ、$0.56kJ$の発熱があった。
この混合溶液の$pH$として最も適当な数値を①~⑧のうちから一つ選べ。
ただし、中和熱は$56kJ/mol$とし、中和反応以外による発熱または吸熱は無視できるものとする。
①$1$ ②$2$ ③$3$ ④$5$ ⑤$9$ ⑥$11$ ⑦$12$ ⑧$13$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問3 平衡定数の計算(基礎)

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
$1.0mol$の気体$A$のみが入った密閉容器に$1.0mol$の気体$B$を加えたところ、気体$C$および$D$が生成して、次式の平衛が成立した。
$A+B⇄C+D$
このときの$C$の物質として最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、容器内の温度と体積は一定とし、子の温度における反応平衛定数は$0.25$とする。
①$0.25$ ②$0.33$ ③$0.50$ ④$0.67$ ⑤$0.75$
この動画を見る
$1.0mol$の気体$A$のみが入った密閉容器に$1.0mol$の気体$B$を加えたところ、気体$C$および$D$が生成して、次式の平衛が成立した。
$A+B⇄C+D$
このときの$C$の物質として最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、容器内の温度と体積は一定とし、子の温度における反応平衛定数は$0.25$とする。
①$0.25$ ②$0.33$ ③$0.50$ ④$0.67$ ⑤$0.75$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問2 メタンハイドレート

単元:
#化学#化学理論#大学入試過去問(化学)#物質の変化と熱・光#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
将来のエネルギー資源として期待されているメタンハイドレートは、水分子 が形成するかご状構造の中にメタン分子が取り込まれた固体物質として海底な どに存在する。メタン1分子あたり平均$5.8$個の水分子で構成されるメタンハ イドレート $1.2kg$から、メタンを気体としてすべて取り出して完全燃焼させる。
次の問い(a・b)に答えよ。
原子量
$H1 C 12 Ο 16$
a 燃焼で消費される酸素の物質量は何$mol$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
①$5.0$ ②$10$ ③$20$ ④$65$ ⑤$75$ ⑥$130$
b このとき発生する熱量は何$kJ$か。
最も適当な数値を、次の①~⑥のうち から一つ選べ。
ただし、気体のメタンの燃焼熱は$890 kJ/mol$とする。
①$8.9 \times 10^2$
②$4.5 \times 10^3$
③$5.8 \times 10^3$
④$8.9 \times 10^3$
⑤$4.5 \times 10^4$
⑥$5.8 \times 10^4$
この動画を見る
将来のエネルギー資源として期待されているメタンハイドレートは、水分子 が形成するかご状構造の中にメタン分子が取り込まれた固体物質として海底な どに存在する。メタン1分子あたり平均$5.8$個の水分子で構成されるメタンハ イドレート $1.2kg$から、メタンを気体としてすべて取り出して完全燃焼させる。
次の問い(a・b)に答えよ。
原子量
$H1 C 12 Ο 16$
a 燃焼で消費される酸素の物質量は何$mol$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
①$5.0$ ②$10$ ③$20$ ④$65$ ⑤$75$ ⑥$130$
b このとき発生する熱量は何$kJ$か。
最も適当な数値を、次の①~⑥のうち から一つ選べ。
ただし、気体のメタンの燃焼熱は$890 kJ/mol$とする。
①$8.9 \times 10^2$
②$4.5 \times 10^3$
③$5.8 \times 10^3$
④$8.9 \times 10^3$
⑤$4.5 \times 10^4$
⑥$5.8 \times 10^4$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第2問 問1 熱化学方程式

単元:
#化学#化学理論#大学入試過去問(化学)#物質の変化と熱・光#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
アンモニア(気)と塩化水素(気)から塩化アンモニウム(固)が生成する反応の反応熱は$176 kJ/mol$である。
塩化アンモニウム(固)の生成熱は何$kJ/mol$か。
最も適当な数値を、次の①~⑧のうちから一つ選べ。
ただし、アンモニア(気) および塩化水素(気)の生成熱は、
それぞれ$46 kJ/mol$ および$92 kJ/mol$である。
①$-314$ ②$-176$ ③$-138$ ④$-38$ ⑤$38$ ⑥$138$ ⑦$176$ ⑧$314$
この動画を見る
アンモニア(気)と塩化水素(気)から塩化アンモニウム(固)が生成する反応の反応熱は$176 kJ/mol$である。
塩化アンモニウム(固)の生成熱は何$kJ/mol$か。
最も適当な数値を、次の①~⑧のうちから一つ選べ。
ただし、アンモニア(気) および塩化水素(気)の生成熱は、
それぞれ$46 kJ/mol$ および$92 kJ/mol$である。
①$-314$ ②$-176$ ③$-138$ ④$-38$ ⑤$38$ ⑥$138$ ⑦$176$ ⑧$314$
