 化学
化学
 化学
化学
共通テスト(旧センター試験)過去問解説 化学 2015年追試 第1問 問2 モル濃度計算

単元:
#化学#化学基礎2ー物質の変化#物質量と濃度#理科(高校生)#化学#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
$20℃,1.013×10^5 Pa$で$560mL$の塩化水素を純水に溶かし、塩酸$50mL$をつくった。
この塩酸のモル濃度は何$mol/L$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
① $0.025$
② $0.050$
③ $0.25$
④ $0.50$
⑤ $2.5$
⑥ $5.0$
この動画を見る
$20℃,1.013×10^5 Pa$で$560mL$の塩化水素を純水に溶かし、塩酸$50mL$をつくった。
この塩酸のモル濃度は何$mol/L$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
① $0.025$
② $0.050$
③ $0.25$
④ $0.50$
⑤ $2.5$
⑥ $5.0$
共通テスト(旧センター試験)過去問解説 化学 2015年追試 第1問 問1 典型元素

単元:
#化学#無機#典型金属元素の単体と化合物#理科(高校生)#化学#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
周期表中の水素以外の典型元素の記述として適当なものを、
次の①~⑤のうちから選べ。
① 同族元素の原子は、同数の価電子をもつ。
② 同族元素の原子は、同じ電子配置をもつ。
③ 同族元素では、化学的性質が互いに類似している。
④ 同一周期では、右にある原子ほど陽子の数が多くなる。
⑤ 第3周期の原子では、最外殻電子がM殻にある。
この動画を見る
周期表中の水素以外の典型元素の記述として適当なものを、
次の①~⑤のうちから選べ。
① 同族元素の原子は、同数の価電子をもつ。
② 同族元素の原子は、同じ電子配置をもつ。
③ 同族元素では、化学的性質が互いに類似している。
④ 同一周期では、右にある原子ほど陽子の数が多くなる。
⑤ 第3周期の原子では、最外殻電子がM殻にある。
【短時間で演習!!】気体の状態方程式の計算問題〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#気体の性質#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
演習編
気体の状態方程式
Q.$27$°C,$2.5 \times 10^6$ Pa で$0.50$Lの窒素の物質量は何mol?
(R=$8.3 \times10^3$Pa・L/(mol·K))
Q.ある揮発性の液体$1.2$gを$102$℃で完全に蒸発させると、$1.0 \times 10^5$Pa で$830$mLの蒸気になった。この液体の分子量は?
(R=$8.3 \times 10^3$Pa・L/(mol·K))
この動画を見る
演習編
気体の状態方程式
Q.$27$°C,$2.5 \times 10^6$ Pa で$0.50$Lの窒素の物質量は何mol?
(R=$8.3 \times10^3$Pa・L/(mol·K))
Q.ある揮発性の液体$1.2$gを$102$℃で完全に蒸発させると、$1.0 \times 10^5$Pa で$830$mLの蒸気になった。この液体の分子量は?
(R=$8.3 \times 10^3$Pa・L/(mol·K))
化学基礎の教科書を解説する動画 第54回 酸化剤と還元剤

無機化学第9回 硫酸の製法(接触法)

【ポイント解説&演習】融点・沸点の大きさ比較〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学基礎1ー物質の構成#原子の構成と元素の周期表#化学結合#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
新課程対応
融点・沸点の大きさ比較の問題の解き方について解説します。
この動画を見る
新課程対応
融点・沸点の大きさ比較の問題の解き方について解説します。
有機化学 二択問題 二糖類の還元性の有無
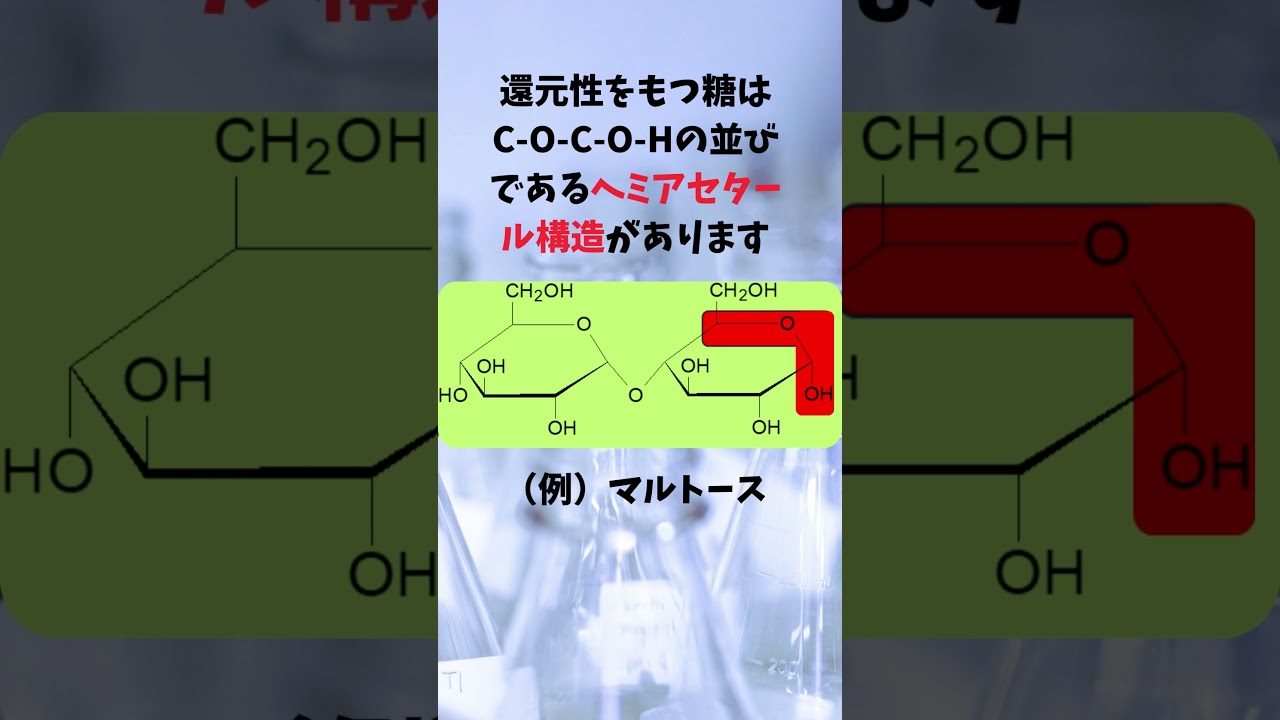
有機化学第11回 アルコール 分類法を覚えることを中心に

共通テスト追試 化学 2023年度 第5問 問4b 浸透圧による分子量計算

単元:
#化学#化学理論#溶液の性質#理科(高校生)#化学#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
4 下線部(d)に関する次の問い(a・b)に答えよ。
a 浸透圧 Π に関するファントホッフの法則は,次の式(Ⅰ)のように表すことができる。
$Π = \displaystyle \frac{C_wRT}{M} $
ここで,$C_w$ は質量濃度とよばれ,溶質の質量$w$,溶液の体積 $V$ を用いて
$C_w = \displaystyle \frac{w}{V}$で定義される。
また,$R$ は気体定数,$T$ は絶対温度,$M$ は溶質のモル質量である。
式(1)はスクロースなどの比較的低分子量の非電解質の$M$
の決定に広く用いられている。
$300K,C_w =0.342g/L$のスクロース(分子量 $342$)水溶液の$Π$ は何 $Pa$か。
その数値を有効数字桁の次の形式で表すとき, $\boxed{ 28 } ~\boxed{ 30 } $ に当てはまる数字を,後の①~⓪のうちから一つずつ選べ。
ただし,同じものを繰り返し選んでもよい。
なお,気体定数は $R =8.31×10^3 Pa・L/(K・mol)$とする。
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$
⑥$6$ ⑦$7$ ⑧$8$ ⑨$9$ ⓪$0$
この動画を見る
4 下線部(d)に関する次の問い(a・b)に答えよ。
a 浸透圧 Π に関するファントホッフの法則は,次の式(Ⅰ)のように表すことができる。
$Π = \displaystyle \frac{C_wRT}{M} $
ここで,$C_w$ は質量濃度とよばれ,溶質の質量$w$,溶液の体積 $V$ を用いて
$C_w = \displaystyle \frac{w}{V}$で定義される。
また,$R$ は気体定数,$T$ は絶対温度,$M$ は溶質のモル質量である。
式(1)はスクロースなどの比較的低分子量の非電解質の$M$
の決定に広く用いられている。
$300K,C_w =0.342g/L$のスクロース(分子量 $342$)水溶液の$Π$ は何 $Pa$か。
その数値を有効数字桁の次の形式で表すとき, $\boxed{ 28 } ~\boxed{ 30 } $ に当てはまる数字を,後の①~⓪のうちから一つずつ選べ。
ただし,同じものを繰り返し選んでもよい。
なお,気体定数は $R =8.31×10^3 Pa・L/(K・mol)$とする。
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$
⑥$6$ ⑦$7$ ⑧$8$ ⑨$9$ ⓪$0$
【どうして起こるかを理解!!】コロイド(塩析、凝析、チンダル現象、ブラウン運動、電気泳動)〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#溶液の性質#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
コロイドについて解説します。
塩析、凝析、チンダル現象、ブラウン運動、電気泳動
この動画を見る
コロイドについて解説します。
塩析、凝析、チンダル現象、ブラウン運動、電気泳動
共通テスト追試 化学 2023年度 第5問 問4a "質量濃度"とは?

単元:
#化学#化学基礎2ー物質の変化#物質量と濃度#理科(高校生)#化学#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
下線部(d)に関する次の問い(a・b)に答えよ。
a 浸透圧 $Π$ に関するファントホッフの法則は,
次の式(Ⅰ)のように表すことができる。
$Π =\displaystyle \frac{ C_w RT}{M}$
ここで,$C_w$は質量濃度とよばれ,溶質の質量$w$溶液の体積 $V$ を用いて
$C_w = \displaystyle \frac{ w}{v}$で定義される。
また,$R$ は気体定数,$T$ は絶対温度,$M$ は溶質のモル質量である。
式(Ⅰ)はスクロースなどの比較的低分子量の非電解質の$M$
の決定に広く用いられている。
$300K,C_w =0.342g/L$のスクロース(分子量 342)
水溶液の$Π$ は何$Pa$か。
その数値を有効数字桁の次の形式で表すとき, $\boxed{ 28 } ~\boxed{ 30 }$ に
当てはまる数字を,後の①~⓪のうちから一つずつ選べ。
ただし,同じものを繰り返し選んでもよい。
なお,気体定数は $R =8.31×10^3 Pa・L/(K・mol)$とする。
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$
⑥$6$ ⑦$7$ ⑧$8$ ⑨$9$ ⓪$0$
この動画を見る
下線部(d)に関する次の問い(a・b)に答えよ。
a 浸透圧 $Π$ に関するファントホッフの法則は,
次の式(Ⅰ)のように表すことができる。
$Π =\displaystyle \frac{ C_w RT}{M}$
ここで,$C_w$は質量濃度とよばれ,溶質の質量$w$溶液の体積 $V$ を用いて
$C_w = \displaystyle \frac{ w}{v}$で定義される。
また,$R$ は気体定数,$T$ は絶対温度,$M$ は溶質のモル質量である。
式(Ⅰ)はスクロースなどの比較的低分子量の非電解質の$M$
の決定に広く用いられている。
$300K,C_w =0.342g/L$のスクロース(分子量 342)
水溶液の$Π$ は何$Pa$か。
その数値を有効数字桁の次の形式で表すとき, $\boxed{ 28 } ~\boxed{ 30 }$ に
当てはまる数字を,後の①~⓪のうちから一つずつ選べ。
ただし,同じものを繰り返し選んでもよい。
なお,気体定数は $R =8.31×10^3 Pa・L/(K・mol)$とする。
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$
⑥$6$ ⑦$7$ ⑧$8$ ⑨$9$ ⓪$0$
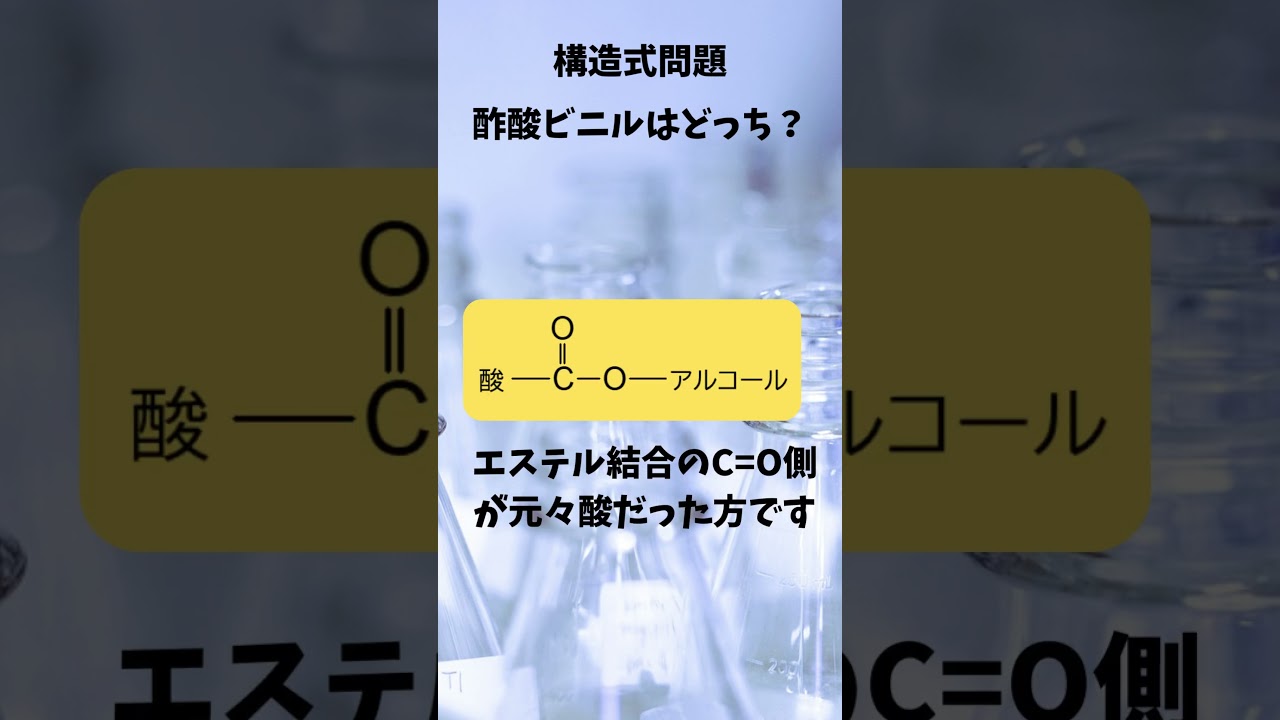
有機化学 命名問題 酢酸ビニルはどっち?
共通テスト(旧センター試験)過去問解説 化学 2015年 第6問 問3 デキストリンの加水分解の計算問題
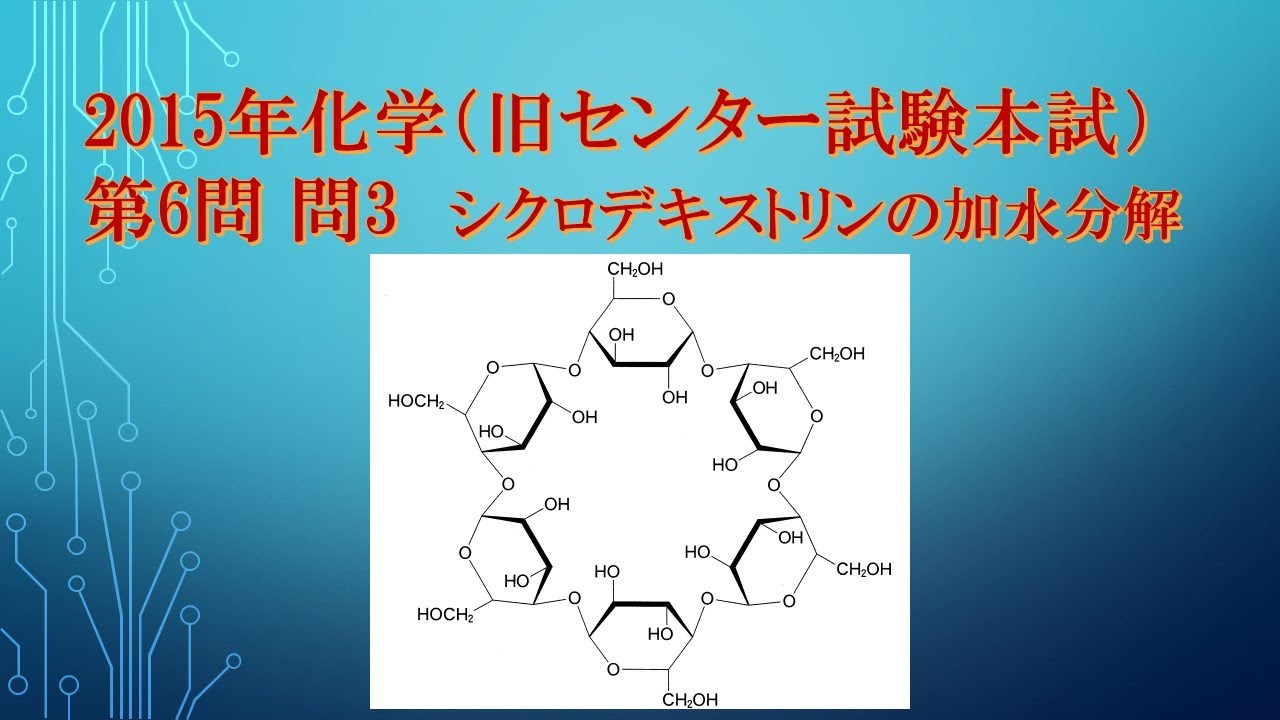
単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
複数のグルコース分子がグリコシド結合を形成して環状構造になったものをシクロデキストリンという。
図1に示すシクロデキストリン $0.10 mol$を完全に加水分解するとグルコースのみが得られた。
このとき反応した水は何$g$か。
最も適当な数値を、下の①~⑥のうちから一つ選べ。
①$1.8$ ②$3.6$ ③$5.4$ ④$7.2$ ⑤$9.0$ ⑥$10.8$
この動画を見る
複数のグルコース分子がグリコシド結合を形成して環状構造になったものをシクロデキストリンという。
図1に示すシクロデキストリン $0.10 mol$を完全に加水分解するとグルコースのみが得られた。
このとき反応した水は何$g$か。
最も適当な数値を、下の①~⑥のうちから一つ選べ。
①$1.8$ ②$3.6$ ③$5.4$ ④$7.2$ ⑤$9.0$ ⑥$10.8$
有機化学 命名問題 アセチルサリチル酸はどっち?
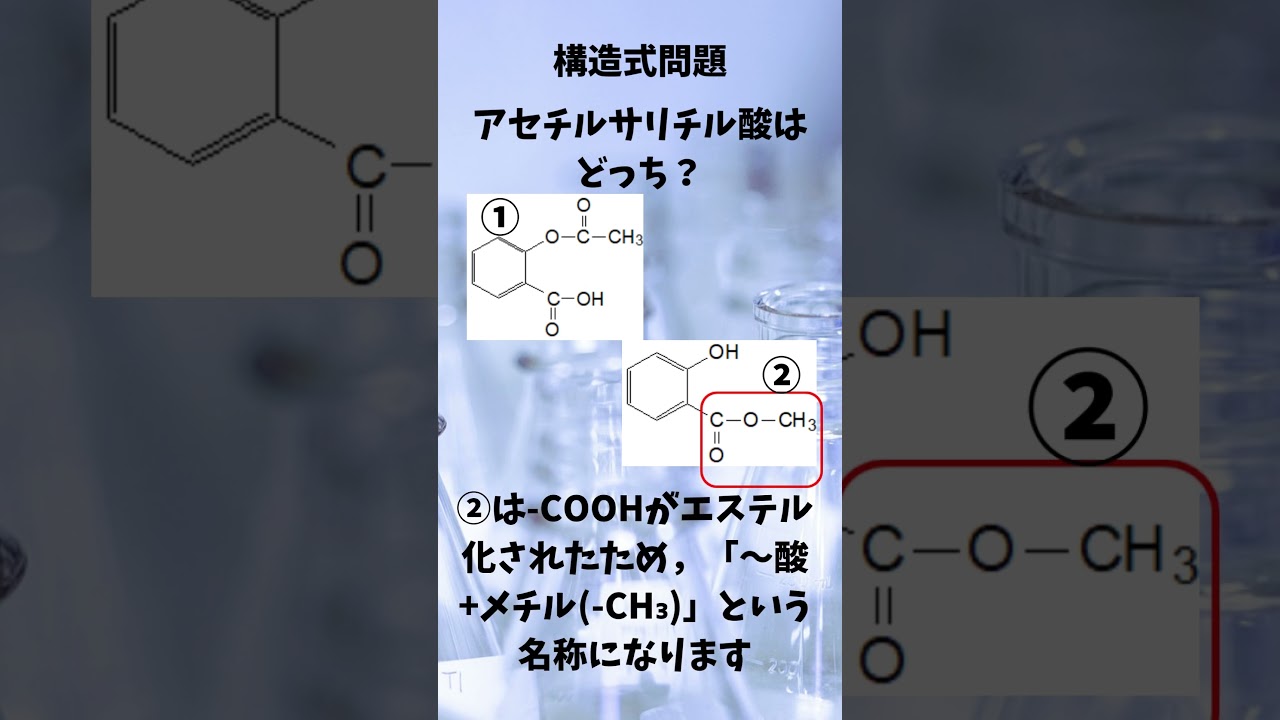
共通テスト追試 化学 2023年度 第4問 問4b エステルの加水分解の量的関係問題

単元:
#化学#有機#大学入試過去問(化学)#酸素を含む脂肪族化合物#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ある植物の葉には、炭素、水素、酸素のみからなるエステルAが含まれている。
$49.0mg$のAを完全に加水分解すると、カルボン酸Bと、分子式 $C_{10}H_{18}O$の1価アルコールC $38.5mg$が得られた。
Bの示性式として最も適当なものを、次の①~④のうちから一つ選べ。
①$CH_3COOH$
②$CH_3CH_2COOH$
③$HOOC-COOH$
④$HOOC-CH_2-COOH$
この動画を見る
ある植物の葉には、炭素、水素、酸素のみからなるエステルAが含まれている。
$49.0mg$のAを完全に加水分解すると、カルボン酸Bと、分子式 $C_{10}H_{18}O$の1価アルコールC $38.5mg$が得られた。
Bの示性式として最も適当なものを、次の①~④のうちから一つ選べ。
①$CH_3COOH$
②$CH_3CH_2COOH$
③$HOOC-COOH$
④$HOOC-CH_2-COOH$
【夏休み】これするだけで理系科目が異常に伸びます。

単元:
#化学#その他#勉強法#その他・勉強法#数学(高校生)#理科(高校生)
指導講師:
カサニマロ【べんとう・ふきのとうの授業動画】
問題文全文(内容文):
夏休みに理系科目の点数をアップさせる方法説明動画です
この動画を見る
夏休みに理系科目の点数をアップさせる方法説明動画です
有機化学 命名問題 この物質の名前は?

共通テスト追試 化学 2023年度 第4問 問3 付加重合で得られる高分子化合物についての簡単な計算問題

単元:
#化学#大学入試過去問(化学)#共通テスト#化学(高分子)#合成樹脂とゴム#合成繊維と天然繊維#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
単量体A$(CH_2=CHC_6H_5)$と単量体B$(CH_2=CHCN)$を反応させることで、共重合体を合成した。
この共重合体中のベンゼン環に結合した水素原子と、それ以外の水素原子の総数の比は、$5:4$であった。
このとき反応した単量体AとBの物質量の比として最も適当なものを、次の①~⑤のうちから一つ選べ。
①$1:3$
②$4:5$
③$1:1$
④$5:4$
⑤$3:1$
この動画を見る
単量体A$(CH_2=CHC_6H_5)$と単量体B$(CH_2=CHCN)$を反応させることで、共重合体を合成した。
この共重合体中のベンゼン環に結合した水素原子と、それ以外の水素原子の総数の比は、$5:4$であった。
このとき反応した単量体AとBの物質量の比として最も適当なものを、次の①~⑤のうちから一つ選べ。
①$1:3$
②$4:5$
③$1:1$
④$5:4$
⑤$3:1$
無機化学第8回 硫黄の単体と化合物 まずは硫化水素と二酸化硫黄

【違いは何!?】結合と結晶の見分け方と組成式と分子式の違い〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学基礎1ー物質の構成#物質の成分と構成元素#化学結合#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
新課程対応
結合と結晶の見分け方と組成式と分子式の違いについて解説します。
Q.次の物質は何結晶?
ヨウ素
マグネシウム
酸化マグネシウム
銅
水
二酸化ケイ素
塩化ナトリウム
ダイヤモンド
スクロース
この動画を見る
新課程対応
結合と結晶の見分け方と組成式と分子式の違いについて解説します。
Q.次の物質は何結晶?
ヨウ素
マグネシウム
酸化マグネシウム
銅
水
二酸化ケイ素
塩化ナトリウム
ダイヤモンド
スクロース
有機化学第10回 アルキン(2) アセチレンの付加反応が中心です

化学基礎の教科書を解説する動画 第53回 酸化数の数え方

共通テスト追試 化学 2023年度 第3問 問4b 酸化物の質量測定やイオン交換樹脂を利用した中和滴定からCu²⁺の量を求める

単元:
#化学#大学入試過去問(化学)#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
純粋な硫酸銅(II)五水和物 $CuSO_4.5H_2O$を$102℃$で
長時間加熱すると三水和物 $CuSO_4.3H_2O$が得られるが、
水和水は加熱中に徐々に失われていく。
そのため、試料全体で平均した組成を化学式 $CuSO_4・xH_2O$で表すと、 $102℃$で加熱した試料では、$x$は$3 \leqq x \leqq 5$を満たす実数となる。
また、さら に高温($150℃$以上)で加熱すると、$x$は$0$まで減少し、硫酸銅(II)無水塩 $CuSO_4$(式量160)が得られる。
加熱により、一部の水和水を失った試料Aがある。
試料Aの化学式$CuSO_4・xH_2O$における$x$の値を求めるための実験について、次の問い (a・b)に答えよ。
ただし、試料中には$Cu^{2+}, SO_4^{2-}$と水和水以外は含ま れないものとする。
b 試料Aにおける$x$の値は、$SO_4^{2-}$の含有量の代わりに、$Cu^{2+}$ の含有量を用いて求めることもできる。
試料A中の$Cu^{2+}$含有量を調べる2通りの手法として、
次の実験Ⅱおよび実験Ⅲを考えた。
実験Ⅱ $Cu^{2+}$を含む水溶液に、水酸化ナトリウム $NaOH$水溶液を十分に加え、生じる沈殿をすべてろ過により取り出し、十分に加熱して純粋な酸化銅(Ⅱ)$CuO$(式量 80)としてから、その質量を求める。
実験Ⅲ $Cu^{2+}$を含む水溶液を、陽イオン交換樹脂を詰めたカラムに通し、 流出液に含まれる水素イオン$H^{+}$の物質量を、中和滴定により求める。
ある質量の試料Aを溶かした水溶液Bを用意し、その$10mL$を用いて実験Ⅱを行ったところ、質量$w (mg)$の$CuO$が得られた。
また、別の$10mL$ の水溶液Bを用いて実験Ⅲを行ったところ、濃度$c(mol/L)$の$NaOH$水溶液が、中和滴定の終点までに$V (mL)$必要であった。
用いた水溶液B中の$Cu^{2+}$が、実験Ⅱではすべて$CuO$となり、実験Ⅲではすべて陽イオン交換樹脂により$H^{+}$に交換されたものとすると、求められる$Cu^{2+}$の含有量の値は、実験Ⅱと実験Ⅲで同じ値となる。
このとき、$w、c、V$の値の関係はどのような式で表されるか。
最も適当なものを、次の①~⑥のうちから一つ選べ。
①$V=\displaystyle \frac{25w}{c}$
②$V=\displaystyle \frac{25w}{2c}$
③$V=\displaystyle \frac{25w}{4c}$
④$V=\displaystyle \frac{w}{40c}$
⑤$V=\displaystyle \frac{w}{80c}$
⑥$V=\displaystyle \frac{w}{160c}$
この動画を見る
純粋な硫酸銅(II)五水和物 $CuSO_4.5H_2O$を$102℃$で
長時間加熱すると三水和物 $CuSO_4.3H_2O$が得られるが、
水和水は加熱中に徐々に失われていく。
そのため、試料全体で平均した組成を化学式 $CuSO_4・xH_2O$で表すと、 $102℃$で加熱した試料では、$x$は$3 \leqq x \leqq 5$を満たす実数となる。
また、さら に高温($150℃$以上)で加熱すると、$x$は$0$まで減少し、硫酸銅(II)無水塩 $CuSO_4$(式量160)が得られる。
加熱により、一部の水和水を失った試料Aがある。
試料Aの化学式$CuSO_4・xH_2O$における$x$の値を求めるための実験について、次の問い (a・b)に答えよ。
ただし、試料中には$Cu^{2+}, SO_4^{2-}$と水和水以外は含ま れないものとする。
b 試料Aにおける$x$の値は、$SO_4^{2-}$の含有量の代わりに、$Cu^{2+}$ の含有量を用いて求めることもできる。
試料A中の$Cu^{2+}$含有量を調べる2通りの手法として、
次の実験Ⅱおよび実験Ⅲを考えた。
実験Ⅱ $Cu^{2+}$を含む水溶液に、水酸化ナトリウム $NaOH$水溶液を十分に加え、生じる沈殿をすべてろ過により取り出し、十分に加熱して純粋な酸化銅(Ⅱ)$CuO$(式量 80)としてから、その質量を求める。
実験Ⅲ $Cu^{2+}$を含む水溶液を、陽イオン交換樹脂を詰めたカラムに通し、 流出液に含まれる水素イオン$H^{+}$の物質量を、中和滴定により求める。
ある質量の試料Aを溶かした水溶液Bを用意し、その$10mL$を用いて実験Ⅱを行ったところ、質量$w (mg)$の$CuO$が得られた。
また、別の$10mL$ の水溶液Bを用いて実験Ⅲを行ったところ、濃度$c(mol/L)$の$NaOH$水溶液が、中和滴定の終点までに$V (mL)$必要であった。
用いた水溶液B中の$Cu^{2+}$が、実験Ⅱではすべて$CuO$となり、実験Ⅲではすべて陽イオン交換樹脂により$H^{+}$に交換されたものとすると、求められる$Cu^{2+}$の含有量の値は、実験Ⅱと実験Ⅲで同じ値となる。
このとき、$w、c、V$の値の関係はどのような式で表されるか。
最も適当なものを、次の①~⑥のうちから一つ選べ。
①$V=\displaystyle \frac{25w}{c}$
②$V=\displaystyle \frac{25w}{2c}$
③$V=\displaystyle \frac{25w}{4c}$
④$V=\displaystyle \frac{w}{40c}$
⑤$V=\displaystyle \frac{w}{80c}$
⑥$V=\displaystyle \frac{w}{160c}$
【違いをしっかり理解!!】希薄溶液の性質(蒸気圧降下・沸点上昇・凝固点降下・浸透圧)〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#溶液の性質#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
希薄溶液の性質について解説します。
蒸気圧降下・沸点上昇・凝固点降下・浸透圧
この動画を見る
希薄溶液の性質について解説します。
蒸気圧降下・沸点上昇・凝固点降下・浸透圧
共通テスト(旧センター試験)過去問解説 化学 2015年 第5問 問3 ビニロンのアセタール化比率の計算

単元:
#化学#大学入試過去問(化学)#共通テスト#化学(高分子)#合成繊維と天然繊維#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図1に示すように、ポリビニルアルコール(繰り返し単位〔$+CHOH-CH_2$〕の式量44)をホルムアルデヒドの水溶液で処理すると、ヒドロキシ基の一部がアセタール化されて、ビニロンが得られる。
ヒドロキシ基の$50%$がアセタール化される場合、ポリビニルアルコール$88g$から得られるビニロンは何$g$か。
最も適当な数値を、下の①~⑥のうちから一つ選べ。
①$91$ ②$94$ ③$96$ ④$98$ ⑤$100$ ⑥$102$
※図は動画内参照
この動画を見る
図1に示すように、ポリビニルアルコール(繰り返し単位〔$+CHOH-CH_2$〕の式量44)をホルムアルデヒドの水溶液で処理すると、ヒドロキシ基の一部がアセタール化されて、ビニロンが得られる。
ヒドロキシ基の$50%$がアセタール化される場合、ポリビニルアルコール$88g$から得られるビニロンは何$g$か。
最も適当な数値を、下の①~⑥のうちから一つ選べ。
①$91$ ②$94$ ③$96$ ④$98$ ⑤$100$ ⑥$102$
※図は動画内参照
共通テスト追試 化学 2023年度 第3問 問4a BaSO₄の沈殿反応を利用したSO₄²⁻の定量問題

単元:
#化学#大学入試過去問(化学)#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
純粋な硫酸銅(II)五水和物 $CuSO_4.5H_2O$を$102℃$で
長時間加熱すると三水和物 $CuSO_4.3H_2O$が得られるが、
水和水は加熱中に徐々に失われていく。
そのため、試料全体で平均した組成を化学式 $CuSO_4・xH_2O$で表すと、 $102℃$で加熱した試料では、$x$は$3 \leqq x \leqq 5$を満たす実数となる。
また、さら に高温($150℃$以上)で加熱すると、$x$は$0$まで減少し、硫酸銅(II)無水塩 $CuSO_4$(式量160)が得られる。
加熱により、一部の水和水を失った試料Aがある。
試料Aの化学式$CuSO_4・xH_2O$における$x$の値を求めるための実験について、次の問い (a・b)に答えよ。
ただし、試料中には$Cu^{2+}, SO_4^{2-}$と水和水以外は含ま れないものとする。
a 試料中の$SO_4^{2-}$ 含有量からxの値を求めるために、
次の実験Ⅰを行った。
実験Ⅰ $1.178g$の試料Aを水に完全に溶かし、塩化バリウム $BaCl_2$水溶液を硫酸バリウム$BaSO_4$(式量 233)の白色沈殿が新たに生じなくなるまで徐々に加えた。
白色沈殿をすべてろ過により取り出し、洗浄、乾燥して質量を求めたところ、$1.165g$であった。
$1.178g$の試料中の$SO_2$がすべて白色沈殿に含まれたと仮定すると、 $x$の値はいくらか。
$x$を小数第1位までの数値として次の形式で表すとき、
$\boxed{ 16 }$ と$\boxed{ 17 }$に当てはまる数字を、
後の①~⓪のうちから一つずつ選べ。
ただし、同じものを繰り返し選んでもよい。
$x =\boxed{ 16 },\boxed{ 17 }$
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$
⑥$6$ ⑦$7$ ⑧$8$ ⑨$9$ ⓪$0$
この動画を見る
純粋な硫酸銅(II)五水和物 $CuSO_4.5H_2O$を$102℃$で
長時間加熱すると三水和物 $CuSO_4.3H_2O$が得られるが、
水和水は加熱中に徐々に失われていく。
そのため、試料全体で平均した組成を化学式 $CuSO_4・xH_2O$で表すと、 $102℃$で加熱した試料では、$x$は$3 \leqq x \leqq 5$を満たす実数となる。
また、さら に高温($150℃$以上)で加熱すると、$x$は$0$まで減少し、硫酸銅(II)無水塩 $CuSO_4$(式量160)が得られる。
加熱により、一部の水和水を失った試料Aがある。
試料Aの化学式$CuSO_4・xH_2O$における$x$の値を求めるための実験について、次の問い (a・b)に答えよ。
ただし、試料中には$Cu^{2+}, SO_4^{2-}$と水和水以外は含ま れないものとする。
a 試料中の$SO_4^{2-}$ 含有量からxの値を求めるために、
次の実験Ⅰを行った。
実験Ⅰ $1.178g$の試料Aを水に完全に溶かし、塩化バリウム $BaCl_2$水溶液を硫酸バリウム$BaSO_4$(式量 233)の白色沈殿が新たに生じなくなるまで徐々に加えた。
白色沈殿をすべてろ過により取り出し、洗浄、乾燥して質量を求めたところ、$1.165g$であった。
$1.178g$の試料中の$SO_2$がすべて白色沈殿に含まれたと仮定すると、 $x$の値はいくらか。
$x$を小数第1位までの数値として次の形式で表すとき、
$\boxed{ 16 }$ と$\boxed{ 17 }$に当てはまる数字を、
後の①~⓪のうちから一つずつ選べ。
ただし、同じものを繰り返し選んでもよい。
$x =\boxed{ 16 },\boxed{ 17 }$
①$1$ ②$2$ ③$3$ ④$4$ ⑤$5$
⑥$6$ ⑦$7$ ⑧$8$ ⑨$9$ ⓪$0$
共通テスト追試 化学 2023年度 第2問 問4b ヘスの法則の計算問題

単元:
#化学#化学理論#大学入試過去問(化学)#物質の変化と熱・光#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
炭素数が4以上の直鎖状のアルカンでは、図3に示すように、
炭素数が1増えると$CH_2$どうしによる$C-C$単結合も一つ増える。
そのため、気体のアルカンの生成熱や燃焼熱を炭素数に対してグラフにすると、$n$が大きくなると直線になることが知られている。
いくつかの直鎖状のアルカンおよび$CO_2$(気)と$H_2O$(気)の$25℃$における生成熱を表に示す。
この温度における直鎖状のアルカン$C_8H_{18}$(気)の燃焼熱は何$kJ/mol$か。
最も適当な数値を、後の①~⑤のうちから一つ選べ。
ただし、生成する$H_2O$は気体である。
必要があれば方眼紙を使うこと。
①$2.09 \times 10^2$
②$4.69 \times 10^2$
③$5.12 \times 10^3$
④$5.15 \times 10^3$
⑤$5.27 \times 10^3$
※図・表は動画内参照
この動画を見る
炭素数が4以上の直鎖状のアルカンでは、図3に示すように、
炭素数が1増えると$CH_2$どうしによる$C-C$単結合も一つ増える。
そのため、気体のアルカンの生成熱や燃焼熱を炭素数に対してグラフにすると、$n$が大きくなると直線になることが知られている。
いくつかの直鎖状のアルカンおよび$CO_2$(気)と$H_2O$(気)の$25℃$における生成熱を表に示す。
この温度における直鎖状のアルカン$C_8H_{18}$(気)の燃焼熱は何$kJ/mol$か。
最も適当な数値を、後の①~⑤のうちから一つ選べ。
ただし、生成する$H_2O$は気体である。
必要があれば方眼紙を使うこと。
①$2.09 \times 10^2$
②$4.69 \times 10^2$
③$5.12 \times 10^3$
④$5.15 \times 10^3$
⑤$5.27 \times 10^3$
※図・表は動画内参照
無機化学第7回 酸素と酸素化合物 半分くらい理論化学の復習です

【ポイントをチェック!!】金属結合と結晶(自由電子・合金)〔現役講師解説、高校化学、化学基礎、2023年度版〕

有機化学第9回 アルキン(1)

