 化学理論
化学理論
 化学理論
化学理論
無機化学第7回 酸素と酸素化合物 半分くらい理論化学の復習です

共通テスト追試 化学 2023年度 第2問 問3 2段階電離の電離定数

単元:
#化学#化学理論#化学反応の速さ#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ある2価の酸$H_2A$は、水溶液中では式(2)と(3)で表されるように二段階で電離する。
(2)$H_2A→H^{+}+HA{-}$
(3)$HA^{-}⇄H^{+}+A^{2-}$
式(2)に示した一段落目の反応は$H_2A$は$H^{+}$と$HA^{-}$に完全に電離し、式(3)に示した二段落目の反応では電離平衛状態になる。
式(3)の反応の平衛定数$K$は次の式(4)で表される。
(4)$\displaystyle \frac{〔H^{+}〕〔A^{2-}〕}{〔HA^{-}〕}$
$H_2A$水溶液のモル濃度$c$、二段階目の反応における$HA{-}$の電離度$a$としたとき。$K$を表す式として最も適当なものを、次の①~④のうちから一つ選べ。
①$\displaystyle \frac{ca^2}{1-a}$ ②$\displaystyle \frac{ca(1+a)}{1-a}$ ③$\displaystyle \frac{ca^2}{1+a}$ ④$\displaystyle \frac{ca(1+2a)}{1+a}$
この動画を見る
ある2価の酸$H_2A$は、水溶液中では式(2)と(3)で表されるように二段階で電離する。
(2)$H_2A→H^{+}+HA{-}$
(3)$HA^{-}⇄H^{+}+A^{2-}$
式(2)に示した一段落目の反応は$H_2A$は$H^{+}$と$HA^{-}$に完全に電離し、式(3)に示した二段落目の反応では電離平衛状態になる。
式(3)の反応の平衛定数$K$は次の式(4)で表される。
(4)$\displaystyle \frac{〔H^{+}〕〔A^{2-}〕}{〔HA^{-}〕}$
$H_2A$水溶液のモル濃度$c$、二段階目の反応における$HA{-}$の電離度$a$としたとき。$K$を表す式として最も適当なものを、次の①~④のうちから一つ選べ。
①$\displaystyle \frac{ca^2}{1-a}$ ②$\displaystyle \frac{ca(1+a)}{1-a}$ ③$\displaystyle \frac{ca^2}{1+a}$ ④$\displaystyle \frac{ca(1+2a)}{1+a}$
【今年からの新しい単元!!】エンタルピーとは何か!?(化学エネルギー・反応エンタルピー・系・外界・発熱反応・吸熱反応)〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#物質の変化と熱・光#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
エンタルピーについて解説します。
化学エネルギー・反応エンタルピー・系・外界・発熱反応・吸熱反応
0:00 先頭
0:26 発熱反応と吸熱反応
2:01 化学エネルギーとは!?
4:47 エンタルピー~発熱反応
この動画を見る
エンタルピーについて解説します。
化学エネルギー・反応エンタルピー・系・外界・発熱反応・吸熱反応
0:00 先頭
0:26 発熱反応と吸熱反応
2:01 化学エネルギーとは!?
4:47 エンタルピー~発熱反応
共通テスト追試 化学 2023年度 第2問 問2 鉛蓄電池の放電に関する計算問題

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
自動車等に用いられる鉛蓄電池は、負極活物質に鉛$Pb$、
正極活物質に酸化鉛(IV)$PbO_{2+}$電解液として希硫酸を用いる。
鉛蓄電池の充電と放電における反応をまとめると次の式(1)で表され、電極の質量が変化するとともに硫酸$H_2SO_4$の濃度が変化する。
(1)$Pb + PbO_2 + 2H_2SO_4 ⇄ 2 PbSO_4 + 2H_2O$
【⇄上部:放電、下部:充電】
濃度 $3.00 mol/L$の硫酸$100mL$を用いた鉛蓄電池を外部回路に接続し、しば らく放電させ、硫酸の濃度が$2.00 mol/L$に低下した。
このとき、外部回路に流れた電気量は何$C$か。
最も適当な数値を次の①~⑥のうちから一つ選べ。
ただし、ファラデー定数は$9.65 \times 10^4C/mol$とし、電極で生じた電子はすべて外部回路を流れたものとする。
また、電極での反応による電解液の体積変化は無視できるものとする。
①$9.65 \times 10^2$
②$1.93 \times 10^2$
③$2.90 \times 10^2$
④$9.65 \times 10^3$
⑤$1.93 \times 10^4$
⑥$2.90 \times 10^4$
この動画を見る
自動車等に用いられる鉛蓄電池は、負極活物質に鉛$Pb$、
正極活物質に酸化鉛(IV)$PbO_{2+}$電解液として希硫酸を用いる。
鉛蓄電池の充電と放電における反応をまとめると次の式(1)で表され、電極の質量が変化するとともに硫酸$H_2SO_4$の濃度が変化する。
(1)$Pb + PbO_2 + 2H_2SO_4 ⇄ 2 PbSO_4 + 2H_2O$
【⇄上部:放電、下部:充電】
濃度 $3.00 mol/L$の硫酸$100mL$を用いた鉛蓄電池を外部回路に接続し、しば らく放電させ、硫酸の濃度が$2.00 mol/L$に低下した。
このとき、外部回路に流れた電気量は何$C$か。
最も適当な数値を次の①~⑥のうちから一つ選べ。
ただし、ファラデー定数は$9.65 \times 10^4C/mol$とし、電極で生じた電子はすべて外部回路を流れたものとする。
また、電極での反応による電解液の体積変化は無視できるものとする。
①$9.65 \times 10^2$
②$1.93 \times 10^2$
③$2.90 \times 10^2$
④$9.65 \times 10^3$
⑤$1.93 \times 10^4$
⑥$2.90 \times 10^4$
火の正体知ってる?

単元:
#化学#化学理論#気体の性質#理科(高校生)
指導講師:
【楽しい授業動画】あきとんとん
問題文全文(内容文):
火は気体なのか,固体なのか,液体なのか
それともプラズマなのか?
この動画を見る
火は気体なのか,固体なのか,液体なのか
それともプラズマなのか?
共通テスト追試 化学 2023年度 第1問 問5b 固体の溶解度の問題 最後の罠に気をつけて

単元:
#化学#化学理論#溶液の性質#理科(高校生)#化学#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図1に示す塩化カリウム$KCI$. 硝酸カリウム$KNO_3$, および硫酸マグネシウ$MgSO_4$の水に対する溶解度曲線を用いて、
固体の溶解および析出に関する後の問い(a・b)に答えよ。
b $MgSO_4$の水溶液を冷却して得られる結晶は、$MgSO_4$の水和物である。
水$100g$に、ある量の$MgSO_4$が溶けている水溶液Aを$14℃$に冷却する。
このとき、析出する$MgSO_4$の水和物の質量が$12.3g$であり、その中の水和水の質量が$6.3g$である場合、冷却前の水溶液Aに溶けている$MgSO_4$の質量は何$g$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
①$28$ ②$30$ ③$32$ ④$34$ ⑤$36$ ⑥$42$
※図は動画内参照
この動画を見る
図1に示す塩化カリウム$KCI$. 硝酸カリウム$KNO_3$, および硫酸マグネシウ$MgSO_4$の水に対する溶解度曲線を用いて、
固体の溶解および析出に関する後の問い(a・b)に答えよ。
b $MgSO_4$の水溶液を冷却して得られる結晶は、$MgSO_4$の水和物である。
水$100g$に、ある量の$MgSO_4$が溶けている水溶液Aを$14℃$に冷却する。
このとき、析出する$MgSO_4$の水和物の質量が$12.3g$であり、その中の水和水の質量が$6.3g$である場合、冷却前の水溶液Aに溶けている$MgSO_4$の質量は何$g$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
①$28$ ②$30$ ③$32$ ④$34$ ⑤$36$ ⑥$42$
※図は動画内参照
共通テスト追試 化学 2023年度 第1問 問3 質量モル濃度

単元:
#化学#化学理論#大学入試過去問(化学)#溶液の性質#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電解質$AB_2$(式量 200)は水中で陽イオン$A^{2+}$と陰イオン$B^{-}$に完全に電離する。
この電解質$AB_2$と非電解質$C$(分子量 150)との混合物$0.50g$が水$100g$に完全に溶けた溶液を考える。
すべての溶質粒子$A^{2+},B^{-},C$を合わせた質量モル濃度が$0.050 mol/kg$であるとき、混合物中の電解質$AB_2$の含有率(質量パーセント)は何$%$か。
最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、水溶液中では$A^{2+},B^{-},C$はそれぞれ単独の溶質粒子として存在するとし、電離以外の化学反応は起こらないものとする。
①$20$ ②$33$ ③$40$ ④$50$ ⑤$67$
この動画を見る
電解質$AB_2$(式量 200)は水中で陽イオン$A^{2+}$と陰イオン$B^{-}$に完全に電離する。
この電解質$AB_2$と非電解質$C$(分子量 150)との混合物$0.50g$が水$100g$に完全に溶けた溶液を考える。
すべての溶質粒子$A^{2+},B^{-},C$を合わせた質量モル濃度が$0.050 mol/kg$であるとき、混合物中の電解質$AB_2$の含有率(質量パーセント)は何$%$か。
最も適当な数値を、次の①~⑤のうちから一つ選べ。
ただし、水溶液中では$A^{2+},B^{-},C$はそれぞれ単独の溶質粒子として存在するとし、電離以外の化学反応は起こらないものとする。
①$20$ ②$33$ ③$40$ ④$50$ ⑤$67$
【違いをしっかり理解!!】固体・気体の溶解度(固液平衡・溶解度曲線・気液平衡・ヘンリーの法則)〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#溶液の性質#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
固体・気体の溶解度について解説します。
固液平衡・溶解度曲線・気液平衡・ヘンリーの法則
0:00 この1本で計算をマスター!
3:24 硝酸カリウムは水$100$gに、$27$℃で$40$g、$80$℃で$169$g溶ける。
$80$℃の飽和水溶液$200$gに含まれる硝酸カリウムは何gか?
5:10 硝酸カリウムは水$100$gに、$40$℃で$64$g、$25$℃で$38$g溶ける。
$40$℃の飽和水溶液$100$gを$25$℃に冷却すると、硝酸カリウムは何g析出するか?
6:32 塩化カリウムは水$100$gに、$10$℃で$30$g、$80$℃で$52$g溶ける。
$80$℃の飽和水溶液$200$gから水$80$gを蒸発させたとき、塩化カリウムは何g析出するか?
7:53 気体の溶解度
10:38 ヘンリーの法則のルール
11:11 押した分だけ溶ける!
11:30 体積は圧力によらず一定である
13:12 $0$℃、$1.01×10^5$Pa (標準状態)において、酸素は$1$Lの水に$44.8$mL溶ける。
$0$°C,$5.05×10^5$Paで、$1$Lの水に溶ける酸素は何g?
18:33 $0$℃、$1.01×10^5$Pa (標準状態)において、メタンは$1$Lの水に$56$mL溶ける。
$0$°C,$2.02×10^5$Paで、$5$Lの水に溶けるメタンは何g?
この動画を見る
固体・気体の溶解度について解説します。
固液平衡・溶解度曲線・気液平衡・ヘンリーの法則
0:00 この1本で計算をマスター!
3:24 硝酸カリウムは水$100$gに、$27$℃で$40$g、$80$℃で$169$g溶ける。
$80$℃の飽和水溶液$200$gに含まれる硝酸カリウムは何gか?
5:10 硝酸カリウムは水$100$gに、$40$℃で$64$g、$25$℃で$38$g溶ける。
$40$℃の飽和水溶液$100$gを$25$℃に冷却すると、硝酸カリウムは何g析出するか?
6:32 塩化カリウムは水$100$gに、$10$℃で$30$g、$80$℃で$52$g溶ける。
$80$℃の飽和水溶液$200$gから水$80$gを蒸発させたとき、塩化カリウムは何g析出するか?
7:53 気体の溶解度
10:38 ヘンリーの法則のルール
11:11 押した分だけ溶ける!
11:30 体積は圧力によらず一定である
13:12 $0$℃、$1.01×10^5$Pa (標準状態)において、酸素は$1$Lの水に$44.8$mL溶ける。
$0$°C,$5.05×10^5$Paで、$1$Lの水に溶ける酸素は何g?
18:33 $0$℃、$1.01×10^5$Pa (標準状態)において、メタンは$1$Lの水に$56$mL溶ける。
$0$°C,$2.02×10^5$Paで、$5$Lの水に溶けるメタンは何g?
【テスト前に要点チェック!!】気体分野のテスト前に確認しておきたいこと(状態方程式・グラフの問題ボイル・シャルルの法則・分圧・理想気体・実在気体)〔現役講師解説、高校化学、化学基礎、

単元:
#化学#化学理論#気体の性質#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
気体分野についてまとめました。
状態方程式・グラフの問題・ボイル・シャルルの法則・分圧・理想気体・実在気体
この動画を見る
気体分野についてまとめました。
状態方程式・グラフの問題・ボイル・シャルルの法則・分圧・理想気体・実在気体
【音声のみで復習できる!!】聞き流し化学基礎 vol.1〔現役塾講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学基礎1ー物質の構成#化学理論#物質の成分と構成元素#物質の三態と状態変化#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
純物質、混合物、単体、化合物、混合物の分離、炎色反応、熱運動、状態変化について復習します。
この動画を見る
純物質、混合物、単体、化合物、混合物の分離、炎色反応、熱運動、状態変化について復習します。
【2つの違いをしっかり理解!!】理想気体と実在気体〔現役講師解説、高校化学、化学基礎、2023年度版〕

【なぜ溶けるのかを理解!!】溶解(極性溶媒・無極性溶媒、親水基・疎水基)〔現役講師解説、高校化学、化学基礎、2023年度版〕

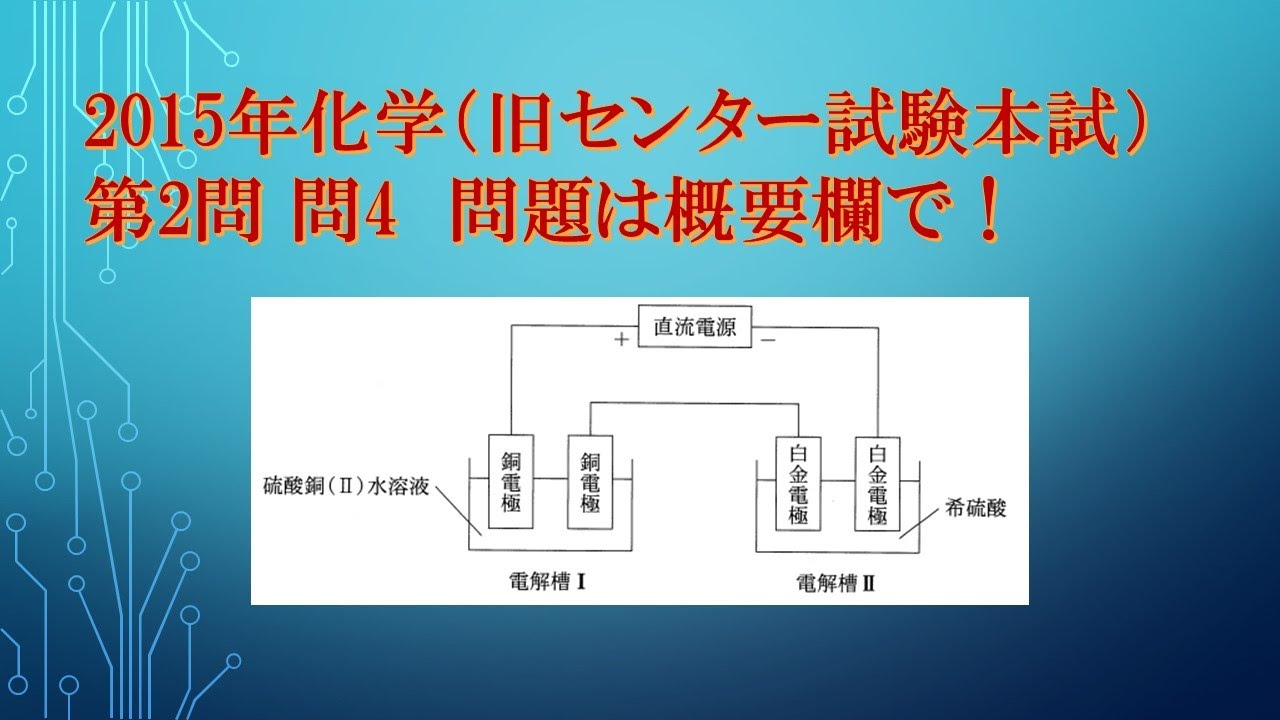
共通テスト(旧センター試験)過去問解説 化学 2015年 第2問 問4 電気分解の問題
単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電解槽Ⅰに硫酸銅(II) 水溶液、電解槽Ⅱに希硫酸を入れた。
さらに、銅電極、白金電極を用いて、図1のような装置を組み立てた。
一定の電流を 1930秒間流して電気分解を行ったところ、
電解槽Ⅰの陰極で$0.32g$の銅が析出した。
下の問い(a・b)に答えよ。
ただし、定数は$9.65 × 104 C/mol$とする。
a 流した電流は何であったか。
最も適当な数値を、次の①~⑤のうちから一つ選べ。
①$0.25$ ②$O.50$ ③$1.0$ ④$2.5$ ⑤$5.0$
b 電解槽Iの陽極と電解槽IIの陽極で起きた現象の組合せとして最も適当な ものを、
次の①~⑥のうちから一つ選べ。
※図・表は動画内参照
この動画を見る
電解槽Ⅰに硫酸銅(II) 水溶液、電解槽Ⅱに希硫酸を入れた。
さらに、銅電極、白金電極を用いて、図1のような装置を組み立てた。
一定の電流を 1930秒間流して電気分解を行ったところ、
電解槽Ⅰの陰極で$0.32g$の銅が析出した。
下の問い(a・b)に答えよ。
ただし、定数は$9.65 × 104 C/mol$とする。
a 流した電流は何であったか。
最も適当な数値を、次の①~⑤のうちから一つ選べ。
①$0.25$ ②$O.50$ ③$1.0$ ④$2.5$ ⑤$5.0$
b 電解槽Iの陽極と電解槽IIの陽極で起きた現象の組合せとして最も適当な ものを、
次の①~⑥のうちから一つ選べ。
※図・表は動画内参照
【この一本で計算の基礎をマスター!!】気体(状態方程式・グラフ、ボイルの法則、シャルルの法則、ボイル・シャルルの法則)〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#気体の性質#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
気体について解説します。
状態方程式・グラフ、ボイルの法則、シャルルの法則、ボイル・シャルルの法則
この動画を見る
気体について解説します。
状態方程式・グラフ、ボイルの法則、シャルルの法則、ボイル・シャルルの法則
共通テスト(旧センター試験)過去問解説 化学 2015年 第2問 問3

単元:
#化学#化学理論#大学入試過去問(化学)#化学平衡と平衡移動#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
表1に示す濃度の硝酸銀水溶液$100mL$と塩化ナトリウム水溶液$100mL$を混合する実験Ⅰ~Ⅲを行った。
実験Ⅰ~Ⅲでの沈殿生成の有無の組み合わせとして、
最も適当なものを、下の①~⑧のうちから一つ選べ。
ただし、塩化銀の溶解度積を、$1.8 × 10^{-10}(mol/L)^2$とする。
※表は動画内参照
この動画を見る
表1に示す濃度の硝酸銀水溶液$100mL$と塩化ナトリウム水溶液$100mL$を混合する実験Ⅰ~Ⅲを行った。
実験Ⅰ~Ⅲでの沈殿生成の有無の組み合わせとして、
最も適当なものを、下の①~⑧のうちから一つ選べ。
ただし、塩化銀の溶解度積を、$1.8 × 10^{-10}(mol/L)^2$とする。
※表は動画内参照
共通テスト(旧センター試験)過去問解説 化学 2015年 第2問 問2

単元:
#化学#化学理論#大学入試過去問(化学)#気体の性質#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
触媒を入れた密閉容器内で次の気体反応の平衛が成立している。
$N_2+3H_2⇄2NH_3$
この状態から、温度一定のままほかの条件を変化させたときの平衛の移動に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
ただし、触媒の体積は無視できるものとする。
① 体積を小さくして容器内の圧力を高くすると、平衛は$NH_3$が減少する方向へ移動する。
② 体積一定で、$H_2$を加えると、平衛は$NH_3$が増加する方向へ移動する。
③ 体積一定で、$NH_3$のみを除去すると、平衛は$N_2$が減少する方向へ移動する。
④ 体積一定で、触媒をさらに加えても、平衛は移動しない。
この動画を見る
触媒を入れた密閉容器内で次の気体反応の平衛が成立している。
$N_2+3H_2⇄2NH_3$
この状態から、温度一定のままほかの条件を変化させたときの平衛の移動に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
ただし、触媒の体積は無視できるものとする。
① 体積を小さくして容器内の圧力を高くすると、平衛は$NH_3$が減少する方向へ移動する。
② 体積一定で、$H_2$を加えると、平衛は$NH_3$が増加する方向へ移動する。
③ 体積一定で、$NH_3$のみを除去すると、平衛は$N_2$が減少する方向へ移動する。
④ 体積一定で、触媒をさらに加えても、平衛は移動しない。
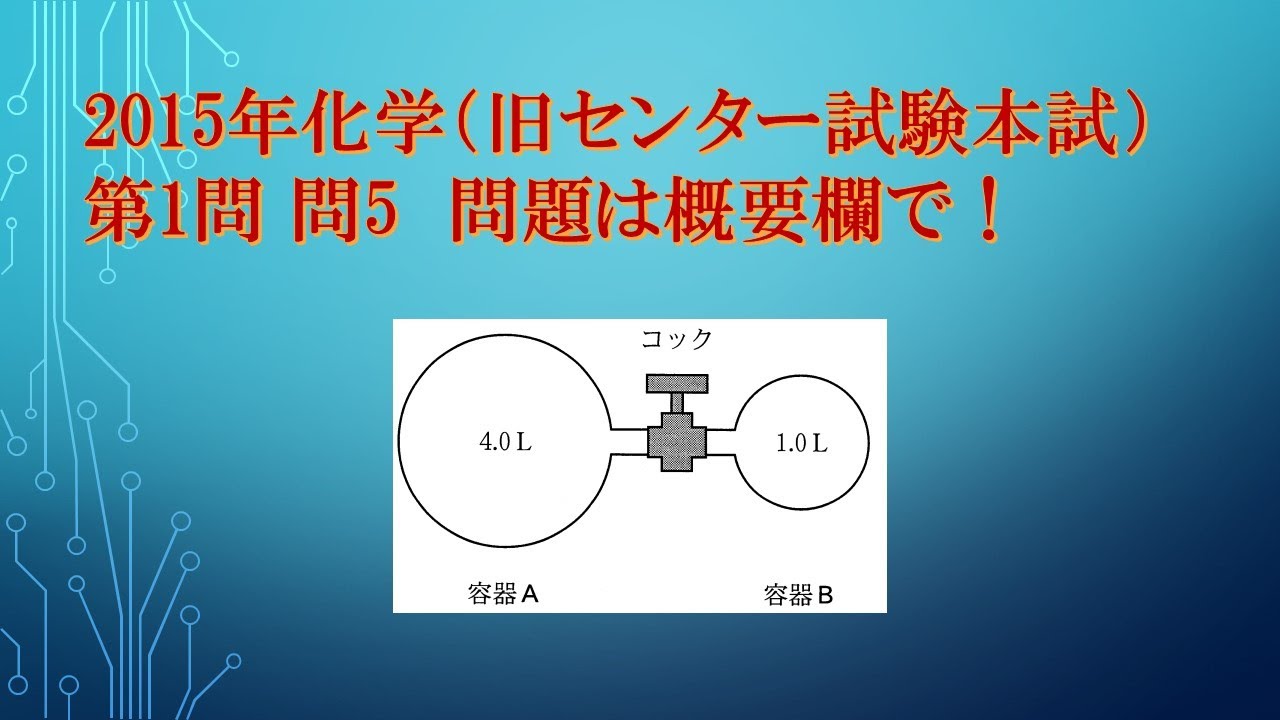
共通テスト(旧センター試験)過去問解説 化学 2015年 第1問 問5
単元:
#化学#化学理論#大学入試過去問(化学)#気体の性質#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
図2のように、容積$4.0L$の容器Aには$1.0×10^5 Pa$のヘリウムが、容積B1.0Lの容器Bには$5.0×10^5 Pa$のアルゴンが入っている。
コックを開いて二つの気体を混合したときの混合気体の全圧は何$Pa$か。
最も適当な数値を、下の①~⑥のうちから一つ選べ。
ただし、コック部の容積は無視する。
また、容器A,Bに入っている気体の温度は同じであり、混合の前後で変わらないもの とする。
①$1.0×10^5$
②$1.2×10^5$
③$1.8×10^5$
④$3.0×10^5$
⑤$4.2×10^5$
⑥$6.0×10^5$
※図は動画内参照
この動画を見る
図2のように、容積$4.0L$の容器Aには$1.0×10^5 Pa$のヘリウムが、容積B1.0Lの容器Bには$5.0×10^5 Pa$のアルゴンが入っている。
コックを開いて二つの気体を混合したときの混合気体の全圧は何$Pa$か。
最も適当な数値を、下の①~⑥のうちから一つ選べ。
ただし、コック部の容積は無視する。
また、容器A,Bに入っている気体の温度は同じであり、混合の前後で変わらないもの とする。
①$1.0×10^5$
②$1.2×10^5$
③$1.8×10^5$
④$3.0×10^5$
⑤$4.2×10^5$
⑥$6.0×10^5$
※図は動画内参照
【用語の意味をしっかり理解!!】蒸気圧(気液平衡、状態図、状態変化)〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学理論#物質の三態と状態変化#気体の性質#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
蒸気圧について解説します。
気液平衡、状態図、状態変化
この動画を見る
蒸気圧について解説します。
気液平衡、状態図、状態変化
【定期テスト対策】化学基礎 一問一答(3)(粒子の熱運動と物質の三態)

単元:
#化学#化学理論#物質の三態と状態変化#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
第1問
空欄(a~b)に適切な語を入れなさい。
物質を構成する粒子は不規則な運動をしている。
これを(a)といい、その結果構成粒子は自然に (b)する。
第2問
空欄(a~b)に適切な語を入れなさい。
物質の三態で状態が変わるのは、物質を構成する粒子の間に(a)がはたらく一方、
粒子は熱運動に よってバラバラになろうとするためである。
固体の 状態では、構成粒子は一般に(b)している。
第3問
関係の深い状態変化の名称を答えなさい。
①濡れていた洗濯物が乾いた。
②冬に室内のガラス窓に水滴がついた。
③ ドライアイスを室内に放置したらなくなった。
④上空で水蒸気が雪に変化した。
⑤気温が上がり雪がとけた。
⑥冷凍庫で氷を作った。
第4問
物理変化に該当するものを選びなさい。
①ガラスが衝撃で割れた。
②水を電気分解した。
③炭を燃やした。
④ドライアイスを水に入れたら泡が出た。
⑤重曹(炭酸水素ナトリウム)を加熱したら 気体が発生した。
第5問
固体を加熱したときの経過時間と温度を表したグラフについて、以下の理由を答えなさい。
①純物質の温度変化であるが、その理由
②温度が上がっていない区間があるがその理由
※グラフは動画内参照
この動画を見る
第1問
空欄(a~b)に適切な語を入れなさい。
物質を構成する粒子は不規則な運動をしている。
これを(a)といい、その結果構成粒子は自然に (b)する。
第2問
空欄(a~b)に適切な語を入れなさい。
物質の三態で状態が変わるのは、物質を構成する粒子の間に(a)がはたらく一方、
粒子は熱運動に よってバラバラになろうとするためである。
固体の 状態では、構成粒子は一般に(b)している。
第3問
関係の深い状態変化の名称を答えなさい。
①濡れていた洗濯物が乾いた。
②冬に室内のガラス窓に水滴がついた。
③ ドライアイスを室内に放置したらなくなった。
④上空で水蒸気が雪に変化した。
⑤気温が上がり雪がとけた。
⑥冷凍庫で氷を作った。
第4問
物理変化に該当するものを選びなさい。
①ガラスが衝撃で割れた。
②水を電気分解した。
③炭を燃やした。
④ドライアイスを水に入れたら泡が出た。
⑤重曹(炭酸水素ナトリウム)を加熱したら 気体が発生した。
第5問
固体を加熱したときの経過時間と温度を表したグラフについて、以下の理由を答えなさい。
①純物質の温度変化であるが、その理由
②温度が上がっていない区間があるがその理由
※グラフは動画内参照
【テストも入試もこれでOK!!】同素体・炎色反応・状態変化・熱運動を詳しく解説!

単元:
#化学#化学基礎1ー物質の構成#化学理論#物質の成分と構成元素#物質の三態と状態変化
指導講師:
3rd School
問題文全文(内容文):
新課程対応
物質の構成について解説します。
同素体・炎色反応・状態変化・熱運動
この動画を見る
新課程対応
物質の構成について解説します。
同素体・炎色反応・状態変化・熱運動
【テーマ別解説】アンモニアソーダ法の反応式を正確に書けるようにするための説明

電気の貯め方とは?

単元:
#化学#化学理論#電池と電気分解#理科(高校生)
指導講師:
【楽しい授業動画】あきとんとん
問題文全文(内容文):
下記質問の解説動画です
電気って触れないのに、どうやって貯めてるの?
この動画を見る
下記質問の解説動画です
電気って触れないのに、どうやって貯めてるの?
【テーマ別解説】オストワルト法の反応式を正確に書けるようにするための説明

単元:
#化学#化学理論#気体の性質#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
オストワルト法
・$NH_3$を$Pt$触媒で$N0$に酸化
・$No→NO_2,Nc_2$を温水に溶かして$HNO_3$
この動画を見る
オストワルト法
・$NH_3$を$Pt$触媒で$N0$に酸化
・$No→NO_2,Nc_2$を温水に溶かして$HNO_3$
テーマ別解説】電離平衡を解説する動画(8) アンモニア水溶液・アンモニア-塩化アンモニウム緩衝液・塩化アンモニウム水溶液のpHを求める

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電離平衡を解説
・アンモニア水
・アンモニア-塩化アンモニウム水溶液
・塩化アンモニウム水溶液
まとめて$pH$を求める。
※図は動画内参照
この動画を見る
電離平衡を解説
・アンモニア水
・アンモニア-塩化アンモニウム水溶液
・塩化アンモニウム水溶液
まとめて$pH$を求める。
※図は動画内参照
【テーマ別解説】電離平衡を解説する動画(7) 加水分解定数を使って塩の水溶液のpHを求める方法

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
$Ka=1.8 \times 10^{-5}mol/L,Kw=1.0 \times 10^{-19}(mol/L)^2$
(例)$0.20mol/L CH_3COOH$ 水溶液$10mL$
$0.20mol/L NaOH$ 水溶液$10mL$
過不足な中和したとき、水溶液の$pH$を求めよ。
$CH_3COOH^{-} + H_2O ⇄CH_3COOH+OH^{-}$
※図は動画内参照
この動画を見る
$Ka=1.8 \times 10^{-5}mol/L,Kw=1.0 \times 10^{-19}(mol/L)^2$
(例)$0.20mol/L CH_3COOH$ 水溶液$10mL$
$0.20mol/L NaOH$ 水溶液$10mL$
過不足な中和したとき、水溶液の$pH$を求めよ。
$CH_3COOH^{-} + H_2O ⇄CH_3COOH+OH^{-}$
※図は動画内参照
【テーマ別解説】電離平衡を解説する動画(6) 加水分解定数はどんなときに使うのか?

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電離平衡を解説
〔加水分解定数〕
$Ka=1.8 \times 10^{-5}mol/L,Kw=1.0 \times 10^{-19}(mol/L)^2$
※図は動画内参照
この動画を見る
電離平衡を解説
〔加水分解定数〕
$Ka=1.8 \times 10^{-5}mol/L,Kw=1.0 \times 10^{-19}(mol/L)^2$
※図は動画内参照
【テーマ別解説】電離平衡を解説する動画(5) 酢酸-酢酸ナトリウムの緩衝液のpHを計算してみよう!

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電離平衡を解説
酢酸-酢酸ナトリウム
緩衝液のpH
$Ka=1.8 \times 10^{-5}mol/L$AのpHは?
この動画を見る
電離平衡を解説
酢酸-酢酸ナトリウム
緩衝液のpH
$Ka=1.8 \times 10^{-5}mol/L$AのpHは?
【テーマ別解説】電離平衡を解説する動画(4) 緩衝液はなぜ緩衝作用をもつのだろうか?

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電離平衡を解説
緩衝液とは何か?
$CH_3COOH+NaOH→CH_3COONa+H_2O$
$(CH_3COO^{-},Na^{+})$
$H^{+}$を加える
$OH^{-}$を加える
※図は動画内参照
この動画を見る
電離平衡を解説
緩衝液とは何か?
$CH_3COOH+NaOH→CH_3COONa+H_2O$
$(CH_3COO^{-},Na^{+})$
$H^{+}$を加える
$OH^{-}$を加える
※図は動画内参照
【テーマ別解説】電離平衡を解説する動画(3) 弱酸水溶液の代表である酢酸水溶液のpHを電離定数から求めよう!

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
電離平衡を解説
酢酸水溶液の$pH$
弱酸水溶液の$pH$
(例)酢酸 $Ka=1.8 \times 10^{-5}mol/L$
※図は動画内参照
この動画を見る
電離平衡を解説
酢酸水溶液の$pH$
弱酸水溶液の$pH$
(例)酢酸 $Ka=1.8 \times 10^{-5}mol/L$
※図は動画内参照
100℃を超える水はあるのか?

単元:
#化学#物質の変化と熱・光#理科(高校生)
指導講師:
【楽しい授業動画】あきとんとん
問題文全文(内容文):
下記質問の解説動画です
ずっと温めてたら水って100℃を超えることあるの?
この動画を見る
下記質問の解説動画です
ずっと温めてたら水って100℃を超えることあるの?
