 化学
化学
 化学
化学
1分で解いてほしい化学計算問題 (41) 元素分析(2回目)

単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[2021年 大阪産業大学(改)]
ある有機化合物$30mg$を完全燃焼させたところ、
二酸化炭素$88mg$と水$54mg$のみが得られた。
この化合物はどれか。
最も適当なものを一つ選べ。
原子量$H1 C 12 O 16$
①$C_2H_5HO$
②$CH_4$
③$C_2H_6$
④$CH_3COOH$
この動画を見る
[2021年 大阪産業大学(改)]
ある有機化合物$30mg$を完全燃焼させたところ、
二酸化炭素$88mg$と水$54mg$のみが得られた。
この化合物はどれか。
最も適当なものを一つ選べ。
原子量$H1 C 12 O 16$
①$C_2H_5HO$
②$CH_4$
③$C_2H_6$
④$CH_3COOH$
【星薬科大学(薬)】令和5年度一般選抜試験(B方式) 溶解度積の計算

単元:
#化学理論#大学入試過去問(化学)#溶液の性質#理科(高校生)#星薬科大学
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
(問題抜粋)$\sqrt{ 2 }=1.41,\sqrt{ 3 }=1.73,\sqrt{ 5 }=2.24,\sqrt{ 7 }=2.65$とする。
硫酸バリウムの溶解度積は$25℃$の条件で$1.00 \times 10^{-10}(mol/L)^2$であり、
極めて水に溶けにくい。
$1.00L$の水に$1.00 \times 10^{-4}mol$の硫酸バリウムを加えて飽和水溶液を調製し、
さらに$1.00 \times 10^{-5}mol$の硫酸を加え、$25℃$の条件で十分な時間をおいた場合、
溶存するバリウムイオンの濃度は何$mol/L$か。
有効数字2桁で答えなさい。
ただし、硫酸バリウム、 硫酸アンモニウムを加えたことによる溶液の体積変化は無視できるものとし、加えた硫酸はすべて電離したものとする。
この動画を見る
(問題抜粋)$\sqrt{ 2 }=1.41,\sqrt{ 3 }=1.73,\sqrt{ 5 }=2.24,\sqrt{ 7 }=2.65$とする。
硫酸バリウムの溶解度積は$25℃$の条件で$1.00 \times 10^{-10}(mol/L)^2$であり、
極めて水に溶けにくい。
$1.00L$の水に$1.00 \times 10^{-4}mol$の硫酸バリウムを加えて飽和水溶液を調製し、
さらに$1.00 \times 10^{-5}mol$の硫酸を加え、$25℃$の条件で十分な時間をおいた場合、
溶存するバリウムイオンの濃度は何$mol/L$か。
有効数字2桁で答えなさい。
ただし、硫酸バリウム、 硫酸アンモニウムを加えたことによる溶液の体積変化は無視できるものとし、加えた硫酸はすべて電離したものとする。
私立専願の人の合格率が20%増える勉強法と心構え

単元:
#化学#その他#国語(中学生)#英語(高校生)#勉強法・その他#勉強法#勉強法#その他#その他・勉強法#その他・勉強法#勉強法#数学(高校生)#理科(高校生)
指導講師:
カサニマロ【べんとう・ふきのとうの授業動画】
問題文全文(内容文):
私立専願の人の合格率が20%増える勉強法と心構え説明動画です
この動画を見る
私立専願の人の合格率が20%増える勉強法と心構え説明動画です
2024年度 共通テスト解説 化学 第3問 問4b NiSの溶解に必要なCl₂の量の計算

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
b 式(1)で$NiCl_2$と塩化銅(I) $CuCI$が得られた水溶液に
塩素$CI_2$を吹き込むと、式(2)に示すように $CuCl$から $CuCl_2$が生じ、再び式(1)の反応に使うことができる。
原子量($S 32 CI 35.5 Ni 59 Cu 64$)
$NIS + 2 CuCl_2 → NICI_2 + 2 CuCl + S$ (1)
$2 CuCl + Cl_2 → 2 CuCl_2$ (2)
$CuCl_2$を$40.5kg$使い、$NiS$を$36.4kg$加えて$Cl_2$を吹き込んだ。
式(1)と(2)の反応によって、すべてのニッケルが$NiCl_2$として水溶液中に溶解し、銅はすべて$CuCl_2$に戻されたとする。
このとき式(1)と(2)の反応で消費された$Cl_2$の物質量は何$mol$か。
最も適当な数値を、次の①~⑧のうちから一つ選べ。
①$150$
②$200$
③$300$
④$350$
⑤$400$
⑥$500$
⑦$550$
⑧$700$
この動画を見る
b 式(1)で$NiCl_2$と塩化銅(I) $CuCI$が得られた水溶液に
塩素$CI_2$を吹き込むと、式(2)に示すように $CuCl$から $CuCl_2$が生じ、再び式(1)の反応に使うことができる。
原子量($S 32 CI 35.5 Ni 59 Cu 64$)
$NIS + 2 CuCl_2 → NICI_2 + 2 CuCl + S$ (1)
$2 CuCl + Cl_2 → 2 CuCl_2$ (2)
$CuCl_2$を$40.5kg$使い、$NiS$を$36.4kg$加えて$Cl_2$を吹き込んだ。
式(1)と(2)の反応によって、すべてのニッケルが$NiCl_2$として水溶液中に溶解し、銅はすべて$CuCl_2$に戻されたとする。
このとき式(1)と(2)の反応で消費された$Cl_2$の物質量は何$mol$か。
最も適当な数値を、次の①~⑧のうちから一つ選べ。
①$150$
②$200$
③$300$
④$350$
⑤$400$
⑥$500$
⑦$550$
⑧$700$
【短時間で要点チェック!!】酸化還元の基礎・酸化数・酸化剤・還元剤〔現役講師解説、高校化学、化学基礎、2023年度版〕

単元:
#化学#化学基礎2ー物質の変化#酸化還元反応#理科(高校生)
指導講師:
3rd School
問題文全文(内容文):
要点チェック!
酸化還元の基礎・酸化数・酸化剤・還元剤のまとめ
この動画を見る
要点チェック!
酸化還元の基礎・酸化数・酸化剤・還元剤のまとめ
【北里大学(薬)】令和5年度一般選抜試験(B方式) 酸化物から原子量を求める問題

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#物質量と濃度#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
原子量 $O 16$
ある元素$A$の単体(固体)$1.6g$を容積の変わらない反応容器に酸素とともに密閉し、
完全燃焼させた後、もとの温度に戻したところ、容器の圧力は反応前と同じ値になった。
このとき発生した酸化物は$3.2g$であった。
この元素$A$の原子量として最も適切なものはどれか。
ただし、固体の体積は気体の体積に比べて無視できるものとする。
(1)$12$ (2)$14$ (3)$16$ (4)$20$ (5)$23$
(6)$24$ (7)$28$ (8)$31$ (9)$32$ (10)$40$
この動画を見る
原子量 $O 16$
ある元素$A$の単体(固体)$1.6g$を容積の変わらない反応容器に酸素とともに密閉し、
完全燃焼させた後、もとの温度に戻したところ、容器の圧力は反応前と同じ値になった。
このとき発生した酸化物は$3.2g$であった。
この元素$A$の原子量として最も適切なものはどれか。
ただし、固体の体積は気体の体積に比べて無視できるものとする。
(1)$12$ (2)$14$ (3)$16$ (4)$20$ (5)$23$
(6)$24$ (7)$28$ (8)$31$ (9)$32$ (10)$40$
2024年度 共通テスト解説 化学 第2問 問4b 電離定数を求める

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#酸と塩基・水素イオン濃度#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
b モル濃度 $0.10 mol/L$の$HA$水溶液$10.0mL$に、
モル濃度$0.10 mol/L$の$NaOH$水溶液を滴下すると、
水溶液中の$HA. H^{+}. A^{-}. OH^{-}$のモル濃度
$[HA]. [H^{+}]. [A^{-}]. [OH^{-}]$は、図1のように変化する。
$NaOH$水溶液の滴下量が$2.5mL$のとき、$H^{+}$のモル濃度は $[H^{+}] = 8.1 \times 10^{-5}$である。
弱酸$HA$の電離定数$K_2$は何$mol/L$か。
最も適当な数値を、後の①~⑥のうちから一つ選べ。
①$2.0 \times 10^{-3}$
②$2.7 \times 10^{-5}$
③$1.1 \times 10^{-4}$
④$2.4 \times 10^{-4}$
⑤$3.2 \times 10^{-4}$
⑥$6.7 \times 10^{-3}$
この動画を見る
b モル濃度 $0.10 mol/L$の$HA$水溶液$10.0mL$に、
モル濃度$0.10 mol/L$の$NaOH$水溶液を滴下すると、
水溶液中の$HA. H^{+}. A^{-}. OH^{-}$のモル濃度
$[HA]. [H^{+}]. [A^{-}]. [OH^{-}]$は、図1のように変化する。
$NaOH$水溶液の滴下量が$2.5mL$のとき、$H^{+}$のモル濃度は $[H^{+}] = 8.1 \times 10^{-5}$である。
弱酸$HA$の電離定数$K_2$は何$mol/L$か。
最も適当な数値を、後の①~⑥のうちから一つ選べ。
①$2.0 \times 10^{-3}$
②$2.7 \times 10^{-5}$
③$1.1 \times 10^{-4}$
④$2.4 \times 10^{-4}$
⑤$3.2 \times 10^{-4}$
⑥$6.7 \times 10^{-3}$
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第7問 問1 セルロースのアセチル化

単元:
#化学#大学入試過去問(化学)#共通テスト#化学(高分子)#糖類#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
原子量$H1 C12 0 16$
ジアセルロースは繊維の原料である。
いま、セルロース(繰り返し単位の式量$162$)
$16.2g$を少量の濃硫酸を触媒として無水酢酸と反応させ、
すべてのヒドロキシ基をアセチル化し、トリアセチルセルロースを得た。
これをおだやかな条件で加水分解し、ジアセチルロースを得た。
得られたジアセチルセルロースは何$g$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、トリアセチルセルロースは完全にジアセチルセルロー スになるものとする。
①$10.4$
②$10.7$
③$24.6$
④$25.2$
⑤$28.8$
⑥$29.7$
この動画を見る
原子量$H1 C12 0 16$
ジアセルロースは繊維の原料である。
いま、セルロース(繰り返し単位の式量$162$)
$16.2g$を少量の濃硫酸を触媒として無水酢酸と反応させ、
すべてのヒドロキシ基をアセチル化し、トリアセチルセルロースを得た。
これをおだやかな条件で加水分解し、ジアセチルロースを得た。
得られたジアセチルセルロースは何$g$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、トリアセチルセルロースは完全にジアセチルセルロー スになるものとする。
①$10.4$
②$10.7$
③$24.6$
④$25.2$
⑤$28.8$
⑥$29.7$
金属が勝手にマスクになる理由とは?

2024年度 共通テスト解説 化学 第2問 問4a 弱酸の電離度の変化

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#酸と塩基・水素イオン濃度#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
a 純水に弱酸$HA$を溶解させた水溶液を考える。
$HA$水溶液のモル濃度 $c(mol/L)$と$HA$の電離度$a$の関係を表したグラフとして最も適当なものを、次の①~⑤のうちから一つ選べ。
ただし、$HA$水溶液のモル濃度が $c_0 (mol/L)$のときの$HA$の電離度を$a_0$とし、$a$は1よりも十分小さいものと する。
※図は動画内参照
この動画を見る
a 純水に弱酸$HA$を溶解させた水溶液を考える。
$HA$水溶液のモル濃度 $c(mol/L)$と$HA$の電離度$a$の関係を表したグラフとして最も適当なものを、次の①~⑤のうちから一つ選べ。
ただし、$HA$水溶液のモル濃度が $c_0 (mol/L)$のときの$HA$の電離度を$a_0$とし、$a$は1よりも十分小さいものと する。
※図は動画内参照
2024年度 共通テスト解説 化学 第2問 問3 電池の反応物の質量と電気量の関係

単元:
#化学#化学理論#大学入試過去問(化学)#電池と電気分解#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
アルカリマンガン乾電池、空気亜鉛電池(空気電池)、リチウム電池の、放電における電池全体での反応はそれぞれ式(2)~(4)で表されるものとする。
それぞ れの電池の放電反応において、反応物の総量が$1kg$ 消費されるときに流れる電気量$Q$を比較する。
これらの電池を、$Q$の大きい順に並べたものはどれか。
最も適当なものを、後の①~⑥のうちから一つ選べ。
ただし、反応に関与 する物質の式量(原子量・分子量を含む)は表1に示す値とする。
アルカリマンガン乾電池
$2 MnO_2 + Zn + 2H_2O →2MnO (OH) + Zn(OH)_2$ (2)
空気亜鉛電池
$O_2 + 2Zn →2 ZnO$ (3)
リチウム電池
$Li+ MnO_2 →LiMnO_z$ (4)
※表は動画内参照
この動画を見る
アルカリマンガン乾電池、空気亜鉛電池(空気電池)、リチウム電池の、放電における電池全体での反応はそれぞれ式(2)~(4)で表されるものとする。
それぞ れの電池の放電反応において、反応物の総量が$1kg$ 消費されるときに流れる電気量$Q$を比較する。
これらの電池を、$Q$の大きい順に並べたものはどれか。
最も適当なものを、後の①~⑥のうちから一つ選べ。
ただし、反応に関与 する物質の式量(原子量・分子量を含む)は表1に示す値とする。
アルカリマンガン乾電池
$2 MnO_2 + Zn + 2H_2O →2MnO (OH) + Zn(OH)_2$ (2)
空気亜鉛電池
$O_2 + 2Zn →2 ZnO$ (3)
リチウム電池
$Li+ MnO_2 →LiMnO_z$ (4)
※表は動画内参照
【現役講師による詳しい解説と講評!】2024年共通テスト化学解答解説〔現役塾講師解説、高校化学、化学基礎〕

1分で解いてほしい化学計算問題 (40) 電離度計算(化学基礎範囲)

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#酸と塩基・水素イオン濃度#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
〔2023年 川崎医療福祉大学(改)〕
$0℃, 1.013×10^5Pa$で$560mL$のをすべて水に溶かして$500mL$とした。
この水溶液の水酸化物イオン濃度$ [OH^{-}]は何$mol/L$か、
有効数字2桁で答えなさ い。
ただし、この溶液の電離度は$0.020$とし、アンモニアは理想気体であるとみなす。
この動画を見る
〔2023年 川崎医療福祉大学(改)〕
$0℃, 1.013×10^5Pa$で$560mL$のをすべて水に溶かして$500mL$とした。
この水溶液の水酸化物イオン濃度$ [OH^{-}]は何$mol/L$か、
有効数字2桁で答えなさ い。
ただし、この溶液の電離度は$0.020$とし、アンモニアは理想気体であるとみなす。
これなんで?

2024年共通テスト全問解説化学 #shorts #解答速報 #化学 #共通テスト

2024年度 共通テスト解説 化学 第1問 問4c 一部融解した氷の体積

単元:
#化学#化学理論#大学入試過去問(化学)#物質の変化と熱・光#共通テスト#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
c $1.01 × 10^5 Pa$の圧力のもとにある$0℃$の氷$54g$がヒーターとともに断熱容器の中に入っている。
ヒーターを用いて$6.0kJ$の熱を加えたところ、氷の一部が融解して水になった。
残った氷の体積は何$cm^3$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、氷の融解熱は$6.0 kJ/mol$とし、加えた熱はすべて氷の融解に使われたものとする。
また、氷の密度は 図2から読み取ること。
〔氷の密度:$0.917g/cm^3$〕
①$18$ ②$19$ ③$20$ ④$36$ ⑤$39$ ⑥$40$
この動画を見る
c $1.01 × 10^5 Pa$の圧力のもとにある$0℃$の氷$54g$がヒーターとともに断熱容器の中に入っている。
ヒーターを用いて$6.0kJ$の熱を加えたところ、氷の一部が融解して水になった。
残った氷の体積は何$cm^3$か。
最も適当な数値を、次の①~⑥のうちから一つ選べ。
ただし、氷の融解熱は$6.0 kJ/mol$とし、加えた熱はすべて氷の融解に使われたものとする。
また、氷の密度は 図2から読み取ること。
〔氷の密度:$0.917g/cm^3$〕
①$18$ ②$19$ ③$20$ ④$36$ ⑤$39$ ⑥$40$
2024年共通テスト解答解説速報 化学 【問題別にチャプターになっていますので概要欄より見たい問題に飛んでください】

単元:
#化学#大学入試過去問(化学)#共通テスト#理科(高校生)#大学入試解答速報#化学#共通テスト
指導講師:
理数個別チャンネル
問題文全文(内容文):
こちらの動画は、2024年1月14日(日)に実施された、共通テスト化学解答速報です。
あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
この動画を見る
こちらの動画は、2024年1月14日(日)に実施された、共通テスト化学解答速報です。
あくまで当チャンネルの講師が独自に解説をしているものですので、万が一内容に間違いがございましたらご容赦ください。
2024年度 共通テスト解説 化学 第1問 問2 状態変化に伴う体積変化

単元:
#化学#化学理論#気体の性質#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
温度$111K$,圧力$1.0×10^5 Pa$で、液体のメタン$CH_4$(分子量$16$)の密度は$0.42 g/cm^3$である。
同圧でこの液体$16g$を$300K$まで加熱してすべて気体にしたとき、体積は何倍になるか。
最も適当な数値を、次の①~④のうちから一つ選べ。
ただし、気体定数は$R = 8.3 × 10^3 Pa・L/(K・mol)$とする。
① $6.5 × 10^2$
② $1.3 × 10^3$
③ $1.0 × 10^4$
④ $9.6 × 10^5$
この動画を見る
温度$111K$,圧力$1.0×10^5 Pa$で、液体のメタン$CH_4$(分子量$16$)の密度は$0.42 g/cm^3$である。
同圧でこの液体$16g$を$300K$まで加熱してすべて気体にしたとき、体積は何倍になるか。
最も適当な数値を、次の①~④のうちから一つ選べ。
ただし、気体定数は$R = 8.3 × 10^3 Pa・L/(K・mol)$とする。
① $6.5 × 10^2$
② $1.3 × 10^3$
③ $1.0 × 10^4$
④ $9.6 × 10^5$
2024年共通テスト化学の講評と全問解説

【現役講師による詳しい解説と講評!】2024年共通テスト化学基礎解答解説〔現役塾講師解説、高校化学、化学基礎〕

単元:
#化学#大学入試過去問(化学)#共通テスト#理科(高校生)#大学入試解答速報#化学#共通テスト
指導講師:
3rd School
問題文全文(内容文):
2024年共通テスト化学基礎解説動画です
この動画を見る
2024年共通テスト化学基礎解説動画です
有機化学第36回【最終回】 芳香族化合物の分離②(問題演習

単元:
#化学#有機#芳香族化合物#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
有機化学第36回【最終回】 芳香族化合物の分離②(問題演習)
※図は動画内参照
この動画を見る
有機化学第36回【最終回】 芳香族化合物の分離②(問題演習)
※図は動画内参照
これほんまなん?

単元:
#化学#化学理論#物質の三態と状態変化#理科(高校生)
指導講師:
【楽しい授業動画】あきとんとん
問題文全文(内容文):
カナダで水が綺麗に凍る動画が本当なのかに関して解説していきます。
この動画を見る
カナダで水が綺麗に凍る動画が本当なのかに関して解説していきます。
1分で解いてほしい化学計算問題 (39) ポリマーの完全燃焼

単元:
#化学#化学理論#大学入試過去問(化学)#物質の変化と熱・光#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[2023年 京都薬科大学B方式(改)]
重合度$n$が$1.2×10^4$のポリイソプレン$1.7g$を完全燃焼させたとき、発生する二酸化炭素は最大何$g$か、四捨五入して小数第1位まで求めよ。
ただし、両末端の置換基を考慮する必要はない。
※イソプレンの化学式:$H_2C=C(CH_3)-CH=CH_2$
原子量 $H=1.0 C=12 O=16$
この動画を見る
[2023年 京都薬科大学B方式(改)]
重合度$n$が$1.2×10^4$のポリイソプレン$1.7g$を完全燃焼させたとき、発生する二酸化炭素は最大何$g$か、四捨五入して小数第1位まで求めよ。
ただし、両末端の置換基を考慮する必要はない。
※イソプレンの化学式:$H_2C=C(CH_3)-CH=CH_2$
原子量 $H=1.0 C=12 O=16$
【化学】古い過去問 センター試験2002年度 第2問 問1 ヘンリーの法則

単元:
#化学#化学理論#気体の性質#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
温度一定で、圧力を変えて、一定量の水に溶解する窒素の量を調べた。
下のグラフに、窒素の圧力(横軸)と、溶解した窒素の量(縦軸)の関係を示す。
次の問い(a・b)に答えよ。
ただし、窒素は理想気体とみなす。
a 溶解した窒素の量を物質量で示すグラフとして、
最も適当なものを、次の①~④のうちから一つ選べ。
b 溶解した窒素の量をそのときの圧力における体積で示すグラフとして、
最も適当なものを、次の①~④のうちから一つ選べ。
※(a・b)のグラフは動画内参照
この動画を見る
温度一定で、圧力を変えて、一定量の水に溶解する窒素の量を調べた。
下のグラフに、窒素の圧力(横軸)と、溶解した窒素の量(縦軸)の関係を示す。
次の問い(a・b)に答えよ。
ただし、窒素は理想気体とみなす。
a 溶解した窒素の量を物質量で示すグラフとして、
最も適当なものを、次の①~④のうちから一つ選べ。
b 溶解した窒素の量をそのときの圧力における体積で示すグラフとして、
最も適当なものを、次の①~④のうちから一つ選べ。
※(a・b)のグラフは動画内参照
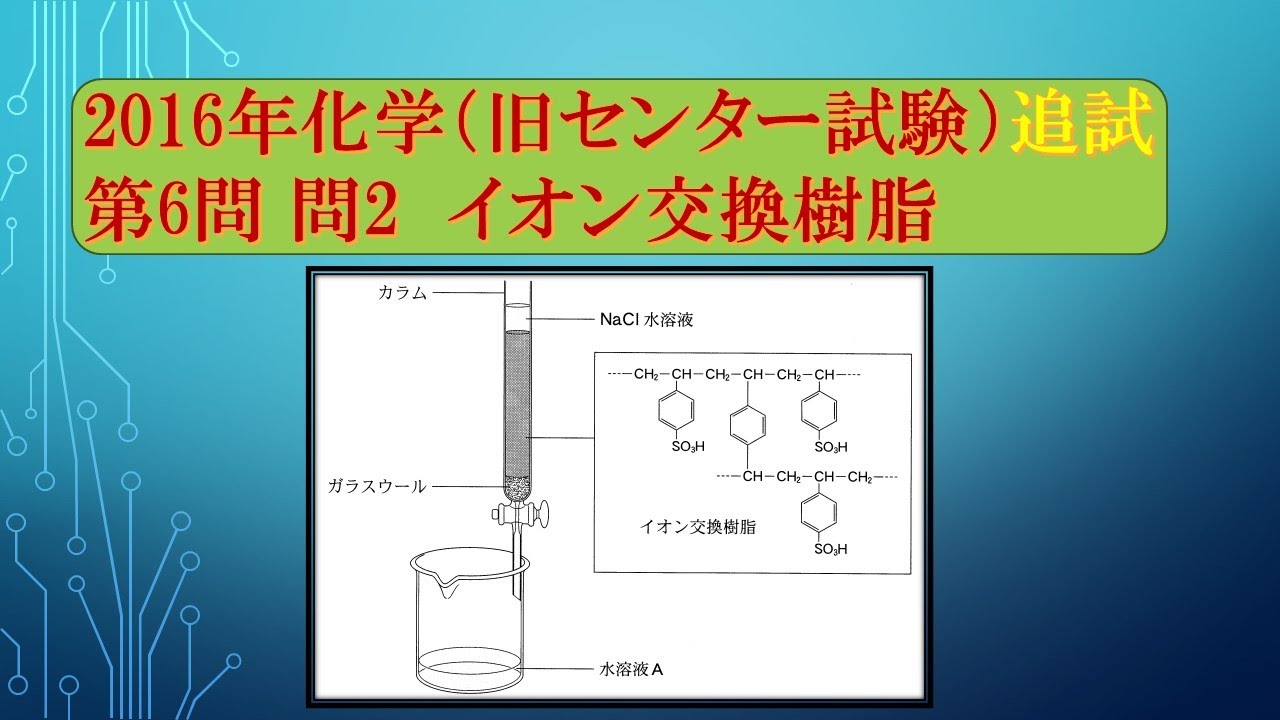
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第6問 問2 イオン交換樹脂
単元:
#化学#大学入試過去問(化学)#共通テスト#化学(高分子)#合成樹脂とゴム#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
$NaCl$ 水溶液を、図1に示すイオン交換樹脂をつめたカラムに通して、イオン交換された水溶液Aを得た。
この水溶液の性質(液性)と、Aに含まれる。
水素イオンと水酸化物イオン以外のイオンの組合せとして最も適当なものを下の①~⑥のうちから一つ選べ。
ただし、イオン交換樹脂は水溶液に含まれるイオンの量に対して十分な量を用いたものとする。
※図・表は動画内参照
この動画を見る
$NaCl$ 水溶液を、図1に示すイオン交換樹脂をつめたカラムに通して、イオン交換された水溶液Aを得た。
この水溶液の性質(液性)と、Aに含まれる。
水素イオンと水酸化物イオン以外のイオンの組合せとして最も適当なものを下の①~⑥のうちから一つ選べ。
ただし、イオン交換樹脂は水溶液に含まれるイオンの量に対して十分な量を用いたものとする。
※図・表は動画内参照
1分で解いてほしい化学計算問題 (38) 混合気体の燃焼

単元:
#化学#化学基礎2ー物質の変化#化学変化と化学反応式#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
[2023年 京都先端科学大学]
メタンとの混合気体$100mL$を空気中で完全燃焼させ、二酸化炭素が$180mL$生成した。
混合気体中に含まれていたプロパンの体積は何$mL$か。
次の①~⑤のうちから最も近い値を一つ選びなさい。
ただし、気体の体積はすべて標準状態$(0℃,1.013 ×10^5Pa )$のものとする。
$① 10 ② 20 ③ 40 ④ 60 ⑤ 80$
この動画を見る
[2023年 京都先端科学大学]
メタンとの混合気体$100mL$を空気中で完全燃焼させ、二酸化炭素が$180mL$生成した。
混合気体中に含まれていたプロパンの体積は何$mL$か。
次の①~⑤のうちから最も近い値を一つ選びなさい。
ただし、気体の体積はすべて標準状態$(0℃,1.013 ×10^5Pa )$のものとする。
$① 10 ② 20 ③ 40 ④ 60 ⑤ 80$
これホンマなん?
有機化学第35回 芳香族化合物の分離①(基本的な考え方)

単元:
#化学#有機#芳香族化合物#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
考え方:塩は水層、塩でなければエーテル層
①$+Cℓ$
②$+NaHCO_3$
③$+NaOH$
※図は動画内参照
この動画を見る
考え方:塩は水層、塩でなければエーテル層
①$+Cℓ$
②$+NaHCO_3$
③$+NaOH$
※図は動画内参照
【化学】硫酸の濃度換算

単元:
#化学#化学基礎2ー物質の変化#化学変化と化学反応式#理科(高校生)
指導講師:
理数個別チャンネル
問題文全文(内容文):
密度18.6g/cm³、質量パーセント濃度98%濃硫酸のモル濃度を求めよ
$H_2SO_4$の分子量98.0
この動画を見る
密度18.6g/cm³、質量パーセント濃度98%濃硫酸のモル濃度を求めよ
$H_2SO_4$の分子量98.0
共通テスト(旧センター試験)過去問解説 化学 2016年追試 第6問 問1 繰り返し単位の数

単元:
#化学#大学入試過去問(化学)#共通テスト#化学(高分子)#合成繊維と天然繊維#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
高分子化合物の平均分子量は、その希薄水溶液の浸透圧から求めることができる。
いま、(繰り返し単位の式量$44$) $0.50g$を水に溶解させて$50mL$とした希薄水溶液の浸透圧は、$27℃$で$8.3×10^2 Pa$であった。
このポリビニルアルコールの平均重合度として最も適当な数値を、 次の①~⑥のうちから一つ選べ。
ただし、気体定数は$R = 8.3×10^3Pa・L/(K・mol )$とする。
①$6.2 ×10^2$
②$6.8 ×10^2$
③$6.2 ×10^3$
④$6.8 ×10^3$
⑤$6.2 ×10^4$
⑥$6.8 ×10^4$
この動画を見る
高分子化合物の平均分子量は、その希薄水溶液の浸透圧から求めることができる。
いま、(繰り返し単位の式量$44$) $0.50g$を水に溶解させて$50mL$とした希薄水溶液の浸透圧は、$27℃$で$8.3×10^2 Pa$であった。
このポリビニルアルコールの平均重合度として最も適当な数値を、 次の①~⑥のうちから一つ選べ。
ただし、気体定数は$R = 8.3×10^3Pa・L/(K・mol )$とする。
①$6.2 ×10^2$
②$6.8 ×10^2$
③$6.2 ×10^3$
④$6.8 ×10^3$
⑤$6.2 ×10^4$
⑥$6.8 ×10^4$
