 化学
化学
 化学
化学
【旧センター試験化学】2019追試 第2問 問5 緩衝液ができる条件

単元:
#化学#化学理論#化学平衡と平衡移動#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問5
2種類の水溶液を同体積ずつ混合したとき,緩衝液が得られる水溶液の組合
せとして最も適当なものを,次の①~⑤のうちから一つ選べ。
①0.10 mol/Lの塩酸と0.10mol/Lのアンモニア水
②0.10 mol/Lの塩酸と0.20mol/Lのアンモニア水
③0.10 mol/Lの塩酸と0.10 mol/Lの水酸化ナトリウム水溶液
④0.10 mol/Lの硫酸水溶液と0.20mol/Lのアンモニア水
⑤0.10 mol/Lの硫酸水溶液と0.20mol/Lの水酸化ナトリウム水溶液
この動画を見る
問5
2種類の水溶液を同体積ずつ混合したとき,緩衝液が得られる水溶液の組合
せとして最も適当なものを,次の①~⑤のうちから一つ選べ。
①0.10 mol/Lの塩酸と0.10mol/Lのアンモニア水
②0.10 mol/Lの塩酸と0.20mol/Lのアンモニア水
③0.10 mol/Lの塩酸と0.10 mol/Lの水酸化ナトリウム水溶液
④0.10 mol/Lの硫酸水溶液と0.20mol/Lのアンモニア水
⑤0.10 mol/Lの硫酸水溶液と0.20mol/Lの水酸化ナトリウム水溶液
理論化学基礎演習20 四酸化二窒素と二酸化窒素の平衡反応

単元:
#化学#化学理論#無機#化学平衡と平衡移動#非金属元素の単体と化合物#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
容積を変えることができる密閉容器に四酸化二窒素を封入してしばらく放置しておくと、
四酸化二窒素の一部は二酸化窒素に変化し、平衡状態に達する。
NO ⇄2NO₂放置したところ、新たな平衡状態に達した。このとき、容器内に存在する二酸化窒素は何molか、有効数字3桁で求めよ。
※必要ならば、用いること。 sqrt 2 =1.41. sqrt(3) = 1.73 , sqrt 7 =2.64, sqrt 13 =3.61 xi
この動画を見る
容積を変えることができる密閉容器に四酸化二窒素を封入してしばらく放置しておくと、
四酸化二窒素の一部は二酸化窒素に変化し、平衡状態に達する。
NO ⇄2NO₂放置したところ、新たな平衡状態に達した。このとき、容器内に存在する二酸化窒素は何molか、有効数字3桁で求めよ。
※必要ならば、用いること。 sqrt 2 =1.41. sqrt(3) = 1.73 , sqrt 7 =2.64, sqrt 13 =3.61 xi
これホンマなん?
単元:
#化学#有機#有機化合物と人間生活#理科(高校生)
指導講師:
【楽しい授業動画】あきとんとん
問題文全文(内容文):
パストリーゼという商品がサトウキビからのアルコールからできているということについての動画です
この動画を見る
パストリーゼという商品がサトウキビからのアルコールからできているということについての動画です
【旧センター試験化学】2019追試 第2問 問4 圧平衡定数

単元:
#化学#大学入試過去問(化学)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
容積一定の密閉容器中で、物質量比1:3のN」とHを反応させたとき、平衡状態では$p_N₂ = 1.0×10^5 $Pa. $P_H₂= 3.0 × 10^5$ Paであった。このときの平衡定数を$K_p=3.0 × 10^{-10} $Pa$^{-2}$とすると、最初に容器内にあったN₂ の物質量の何%がNH$ _2$に変化したか。最も適当な数値を、次の①~⑤のうちから一つ選べ。
この動画を見る
容積一定の密閉容器中で、物質量比1:3のN」とHを反応させたとき、平衡状態では$p_N₂ = 1.0×10^5 $Pa. $P_H₂= 3.0 × 10^5$ Paであった。このときの平衡定数を$K_p=3.0 × 10^{-10} $Pa$^{-2}$とすると、最初に容器内にあったN₂ の物質量の何%がNH$ _2$に変化したか。最も適当な数値を、次の①~⑤のうちから一つ選べ。
【旧センター試験化学】2019追試 第2問 問2 ダニエル電池

単元:
#化学#大学入試過去問(化学)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問2
図1(問題文の図参照)に示すように,素焼きの板で仕切られた容器の一方に硫酸亜鉛水溶液を入れて亜鉛板を浸し,もう一方に硫酸銅(Ⅱ)水溶液を入れて銅板を浸した後,これらの金属板を豆電球を導線でつないだ。このとき,導線を流れた電流の向き(アまたはイ)および放電後の亜鉛版と銅板の合計質量の変化の組合せとして最も適切なものを,下の①~⑥のうちから一つ選べ。
① ア 増加する
② ア 変化しない
③ ア 減少する
④ イ 増加する
⑤ イ 変化しない
⑥ イ 減少する
この動画を見る
問2
図1(問題文の図参照)に示すように,素焼きの板で仕切られた容器の一方に硫酸亜鉛水溶液を入れて亜鉛板を浸し,もう一方に硫酸銅(Ⅱ)水溶液を入れて銅板を浸した後,これらの金属板を豆電球を導線でつないだ。このとき,導線を流れた電流の向き(アまたはイ)および放電後の亜鉛版と銅板の合計質量の変化の組合せとして最も適切なものを,下の①~⑥のうちから一つ選べ。
① ア 増加する
② ア 変化しない
③ ア 減少する
④ イ 増加する
⑤ イ 変化しない
⑥ イ 減少する
【TikTokで1時間で6.5万回再生】理数個別市が尾校メンバーで『白熱!?元素カルタ!!』

単元:
#化学#化学基礎1ー物質の構成#無機#物質の成分と構成元素#原子の構成と元素の周期表#非金属元素の単体と化合物#典型金属元素の単体と化合物#遷移元素の単体と化合物#理科(高校生)
指導講師:
理数個別チャンネル
問題文全文(内容文):
理数個別指導学院市が尾校メンバーで「元素カルタ」で対決しました。
久保田先生VS永田先生・西本先生
(企画・審判・編集:後迫先生)
この動画を見る
理数個別指導学院市が尾校メンバーで「元素カルタ」で対決しました。
久保田先生VS永田先生・西本先生
(企画・審判・編集:後迫先生)
【高校化学】アルコールの構造と異性体【毎週土曜日16時更新!】

単元:
#化学#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
次の各問いに答えよ。
(1) 分子式C₃H₈Oで表される化合物には、構造異性体は何種類あるか。
(2) 分子式C₄H₁₀Oで表されるアルコールについて、次の(a)~(c)にあてはまる化合物の構造式および名称を記せ。
(a) 直鎖状で、酸化されるとアルデヒドを生じる。
(b) 鏡像異性体をもつ。
(c) 第三級アルコールである。
この動画を見る
次の各問いに答えよ。
(1) 分子式C₃H₈Oで表される化合物には、構造異性体は何種類あるか。
(2) 分子式C₄H₁₀Oで表されるアルコールについて、次の(a)~(c)にあてはまる化合物の構造式および名称を記せ。
(a) 直鎖状で、酸化されるとアルデヒドを生じる。
(b) 鏡像異性体をもつ。
(c) 第三級アルコールである。
有機化学基礎演習(18) NBRのアクリロニトリルとブタジエンの構成比を計算しよう!

単元:
#化学#大学入試過去問(化学)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
1,3-ブタジエンとアクリロニトリルの共重合により,平均分子量が53000の共重合体であるアクリロニトリルーブタジエンゴム(通称NBR)が得られた。NBRは石油ホースなどに用いられる。この共重合体の元素分析を行ったところ,成分元素である窒素原子の質量%は11.9%であった。
(1)共重合体中のアクリロニトリルに由来する成分の含有量の質量%を計算せよ。答えは有効数字2桁で書け。
(2)共重合体の1分子中に含まれるブタジエン単位の平均の数(個)を計算せよ。答えは有効数字2桁とし,2.1×10³のように書け。
この動画を見る
1,3-ブタジエンとアクリロニトリルの共重合により,平均分子量が53000の共重合体であるアクリロニトリルーブタジエンゴム(通称NBR)が得られた。NBRは石油ホースなどに用いられる。この共重合体の元素分析を行ったところ,成分元素である窒素原子の質量%は11.9%であった。
(1)共重合体中のアクリロニトリルに由来する成分の含有量の質量%を計算せよ。答えは有効数字2桁で書け。
(2)共重合体の1分子中に含まれるブタジエン単位の平均の数(個)を計算せよ。答えは有効数字2桁とし,2.1×10³のように書け。
【旧センター試験化学】2019追試 第2問 問1 燃料の燃焼と熱量

単元:
#化学#大学入試過去問(化学)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問1
プロパンC₃H₈とブタンC₄H₁₀からなる混合気体があり,その体積は0℃,1.013×10⁵Paで44.8Lである。この混合気体を完全燃焼させたところ,5380kJの熱量が発生した。プロパンとブタンの燃焼熱はそれぞれ2200kJ/mol,2900kJ/molである。混合気体中のプロパンの物質量(mol)と完全燃焼で消費された酸素の物質量(mol)の数値の組合せとして最も適切なものを,次の①~⑥のうちから一つ選べ。
混合気体中のプロパンの物質量 消費された酸素の物質量
① 0.600 7.40
② 0.600 12.1
③ 0.600 16.8
④ 1.40 6.6
⑤ 1.40 10.9
⑥ 1.40 15.2
この動画を見る
問1
プロパンC₃H₈とブタンC₄H₁₀からなる混合気体があり,その体積は0℃,1.013×10⁵Paで44.8Lである。この混合気体を完全燃焼させたところ,5380kJの熱量が発生した。プロパンとブタンの燃焼熱はそれぞれ2200kJ/mol,2900kJ/molである。混合気体中のプロパンの物質量(mol)と完全燃焼で消費された酸素の物質量(mol)の数値の組合せとして最も適切なものを,次の①~⑥のうちから一つ選べ。
混合気体中のプロパンの物質量 消費された酸素の物質量
① 0.600 7.40
② 0.600 12.1
③ 0.600 16.8
④ 1.40 6.6
⑤ 1.40 10.9
⑥ 1.40 15.2
藤川天の医学部模試自己採点【衝撃の内容】

単元:
#物理#化学#英語(高校生)#数学(高校生)#理科(高校生)
指導講師:
Morite2 English Channel
問題文全文(内容文):
藤川天(天ちゃん)、医学部模試の自己採点に挑戦! 超難関テストで**「まさかの高得点」連発**にMorite2先生も驚愕!?
英語で勘で当てた並べ替え問題!?時間切れで「数字しか書いてない」疑惑が浮上! 数学・理科は壊滅…それでも**「医学部目指す」**と語る彼の真意とは?
これは奇跡か、それともただの偶然か?驚きの自己採点結果に隠された真実が今、明らかに! 彼の受験戦略とMorite2先生の鋭いツッコミに注目せよ!
この動画を見る
藤川天(天ちゃん)、医学部模試の自己採点に挑戦! 超難関テストで**「まさかの高得点」連発**にMorite2先生も驚愕!?
英語で勘で当てた並べ替え問題!?時間切れで「数字しか書いてない」疑惑が浮上! 数学・理科は壊滅…それでも**「医学部目指す」**と語る彼の真意とは?
これは奇跡か、それともただの偶然か?驚きの自己採点結果に隠された真実が今、明らかに! 彼の受験戦略とMorite2先生の鋭いツッコミに注目せよ!
無機化学基礎演習(16) アンモニアソーダ法
単元:
#化学#無機#典型金属元素の単体と化合物#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
2024 工学院大学 HIC120 16 Na 23 CI 35.5
炭酸ナトリウムは我々の日常生活において重要な役割を果たしている化合物である。
炭酸ナトリウムは下の図で示されるアンモニアソーダ法(ソルベー法)を用いて工業的に製造することができる。
(図は動画参照)
問1図中の過程で起こる反応の化学反応式を書け。
問2 質量パーセント濃度26.0%の食塩水1,00×10kgを原料として用いたところ。
食塩水中の塩化ナトリウムのうち10.0%が炭酸ナトリウムに変化した。
次の問いに、計算過程を示し、有効数字2桁で答えよ。
(1) 炭酸ナトリウムに変化した塩化ナトリウムの物質量は何molか。
(2) 図中の過程で反応した炭酸水素ナトリウムは何kgか。
(3) 生成した炭酸ナトリウムは何kgか。ただし、生成した炭酸ナトリウムは 無水塩で考えること。
この動画を見る
2024 工学院大学 HIC120 16 Na 23 CI 35.5
炭酸ナトリウムは我々の日常生活において重要な役割を果たしている化合物である。
炭酸ナトリウムは下の図で示されるアンモニアソーダ法(ソルベー法)を用いて工業的に製造することができる。
(図は動画参照)
問1図中の過程で起こる反応の化学反応式を書け。
問2 質量パーセント濃度26.0%の食塩水1,00×10kgを原料として用いたところ。
食塩水中の塩化ナトリウムのうち10.0%が炭酸ナトリウムに変化した。
次の問いに、計算過程を示し、有効数字2桁で答えよ。
(1) 炭酸ナトリウムに変化した塩化ナトリウムの物質量は何molか。
(2) 図中の過程で反応した炭酸水素ナトリウムは何kgか。
(3) 生成した炭酸ナトリウムは何kgか。ただし、生成した炭酸ナトリウムは 無水塩で考えること。
【高校化学】炭化水素の推定【毎週土曜日16時更新!】

単元:
#化学#有機#有機化合物の特徴と構造#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
分子式C₄H₈で表されるアルケンA~Dについて,水素を付加させるとA,B,Cは同一のアルカンになった。A,B,Cへ水を付加させたところ,A,Bからは同一のアルコールXが得られ,CからはアルコールXとYが生じた
(1)AとBはどういった異性体の関係か
(2)AとBが異性体になる理由を記せ
(3)アルケンC,Dおよび,アルコールX,Yの構造式を記せ
(4)C₄H₈で表されるアルケン以外の化合物を記せ
この動画を見る
分子式C₄H₈で表されるアルケンA~Dについて,水素を付加させるとA,B,Cは同一のアルカンになった。A,B,Cへ水を付加させたところ,A,Bからは同一のアルコールXが得られ,CからはアルコールXとYが生じた
(1)AとBはどういった異性体の関係か
(2)AとBが異性体になる理由を記せ
(3)アルケンC,Dおよび,アルコールX,Yの構造式を記せ
(4)C₄H₈で表されるアルケン以外の化合物を記せ
【テーマ別解説】化学・入試に出る赤褐色

単元:
#化学#その他・勉強法
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
①水酸化鉄(Ⅲ)
Fe³⁺を含む水溶液にnaOH水溶液を加えると()色の沈殿を生成し,この沈殿はNaOH水溶液を過剰に加えたとき,{1 溶解する,2 溶解しない}。
②NO₂
※正誤問題
一酸化窒素は,空気に触れると私大に赤褐色を帯びた気体へと変化する。
③Br₂
臭素Br₂は,常温で( )色の液体で,刺激臭のある有毒な上記を発生する。臭素は,有機化合物の不飽和結合の検出や,不飽和度の決定に用いられる。
④Ag₂CrO₄
10mLの溶液Bをコニカルビーカーに移し,純水を適量加えた。そして,コニカルビーカー内に0.5mol/Lのクロク酸カリウム水溶液を指示薬として,数mL加えた。そしてビュレットを用いて1.0×10⁻¹mol/Lの硝酸銀水溶液を滴下したと,滴下直後に白色沈殿Cと赤褐色沈殿Dが生じた。水溶液をよくかき混ぜると,赤褐色沈殿Dは溶解した。さらに硝酸銀使用液の滴下を続けると,送料で12.5mol滴下したところで,新に生じた赤褐色沈殿Dが溶解せずに残るようになった。
この動画を見る
①水酸化鉄(Ⅲ)
Fe³⁺を含む水溶液にnaOH水溶液を加えると()色の沈殿を生成し,この沈殿はNaOH水溶液を過剰に加えたとき,{1 溶解する,2 溶解しない}。
②NO₂
※正誤問題
一酸化窒素は,空気に触れると私大に赤褐色を帯びた気体へと変化する。
③Br₂
臭素Br₂は,常温で( )色の液体で,刺激臭のある有毒な上記を発生する。臭素は,有機化合物の不飽和結合の検出や,不飽和度の決定に用いられる。
④Ag₂CrO₄
10mLの溶液Bをコニカルビーカーに移し,純水を適量加えた。そして,コニカルビーカー内に0.5mol/Lのクロク酸カリウム水溶液を指示薬として,数mL加えた。そしてビュレットを用いて1.0×10⁻¹mol/Lの硝酸銀水溶液を滴下したと,滴下直後に白色沈殿Cと赤褐色沈殿Dが生じた。水溶液をよくかき混ぜると,赤褐色沈殿Dは溶解した。さらに硝酸銀使用液の滴下を続けると,送料で12.5mol滴下したところで,新に生じた赤褐色沈殿Dが溶解せずに残るようになった。
【旧センター試験化学】2019追試 第1問 問4 結晶と非晶質

単元:
#化学#化学基礎1ー物質の構成#化学結合#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問4 いろいろな物質の結晶・非晶質に関する記述として誤りを含むものを、次の
①~⑤のうちから一つ選べ。
① 共有結合でできている結晶には、分子結晶に比べて融点が高いものが多い。
② 金属結晶では、面心立方格子をとる原子の配位数は体心立方格子をとる原子の配位数より多い。
③ イオン結晶では、単位格子に含まれる陽イオンと陰イオンの数の比は、組成式で示されるイオンの数の比と等しい。
④ すべての単体の結晶は共有結合でできている。
⑤ 非品質は一定の融点を示さない。
この動画を見る
問4 いろいろな物質の結晶・非晶質に関する記述として誤りを含むものを、次の
①~⑤のうちから一つ選べ。
① 共有結合でできている結晶には、分子結晶に比べて融点が高いものが多い。
② 金属結晶では、面心立方格子をとる原子の配位数は体心立方格子をとる原子の配位数より多い。
③ イオン結晶では、単位格子に含まれる陽イオンと陰イオンの数の比は、組成式で示されるイオンの数の比と等しい。
④ すべての単体の結晶は共有結合でできている。
⑤ 非品質は一定の融点を示さない。
【旧センター試験化学】2019追試 第1問 問4 結晶と非晶質

単元:
#化学#大学入試過去問(化学)#共通テスト
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問4
いろいろな物質の結晶・非晶質に関する記述として誤りを含むものを,次の①~⑤のうちから一つ選べ。
①共有結合できている結晶には,分子結晶に比べて融点が高いものが多い。
②金属結晶では,両心立方格子をとる原子の配位数は体心立方格子をとる原子の配位数より多い。
③イオン結晶では,単位格子に含まれる陽イオンと陰イオンの数の比は,組成式で示されるイオンの数の比に等しい。
④すべての単体の結晶は共有結合でできている。
⑤非晶質は一定の融点を示さない。
この動画を見る
問4
いろいろな物質の結晶・非晶質に関する記述として誤りを含むものを,次の①~⑤のうちから一つ選べ。
①共有結合できている結晶には,分子結晶に比べて融点が高いものが多い。
②金属結晶では,両心立方格子をとる原子の配位数は体心立方格子をとる原子の配位数より多い。
③イオン結晶では,単位格子に含まれる陽イオンと陰イオンの数の比は,組成式で示されるイオンの数の比に等しい。
④すべての単体の結晶は共有結合でできている。
⑤非晶質は一定の融点を示さない。
1分で解いてほしい化学計算問題 (68) ドライアイスの昇華

単元:
#化学#化学理論#物質の三態と状態変化
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
ドライアイス(密度1.6g/cm³)が昇華すると,0℃,1.013×10⁵Paにおける体積は,固体の時の体積の何倍になるか。整数値で求めなさい。(原子量c 12 o 16,モル体積22.4L/mol)
この動画を見る
ドライアイス(密度1.6g/cm³)が昇華すると,0℃,1.013×10⁵Paにおける体積は,固体の時の体積の何倍になるか。整数値で求めなさい。(原子量c 12 o 16,モル体積22.4L/mol)
【旧センター試験化学】2019追試 第1問 問3 密閉容器内の圧力

単元:
#化学#大学入試過去問(化学)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問3
容積を変えられる密閉容器に入れた水が,気液平衡の状態にある。次の操作Ⅰ・Ⅱにより,水蒸気の圧力はそれぞれ何Paになるか。圧力の数値の組合せとして最も適切なものを,下の①~⑥のうちから一つ選べ。ただし,水の蒸気圧は20℃で2.3×10³Paであり,100℃で1.0×10⁵Paである。また,密閉容器内には常に液体の水が存在し,その体積は無視できるものとする。操作後はすみやかに気液平衡の状態になるものとする。
操作Ⅰ 容器内の温度を20℃に保ち,容器の容積を1.0Lから0.500Lに減少させた。
操作Ⅱ 容器の容積を1.0Lに保ち,容器内の温度を20℃から100℃に上昇させた。
この動画を見る
問3
容積を変えられる密閉容器に入れた水が,気液平衡の状態にある。次の操作Ⅰ・Ⅱにより,水蒸気の圧力はそれぞれ何Paになるか。圧力の数値の組合せとして最も適切なものを,下の①~⑥のうちから一つ選べ。ただし,水の蒸気圧は20℃で2.3×10³Paであり,100℃で1.0×10⁵Paである。また,密閉容器内には常に液体の水が存在し,その体積は無視できるものとする。操作後はすみやかに気液平衡の状態になるものとする。
操作Ⅰ 容器内の温度を20℃に保ち,容器の容積を1.0Lから0.500Lに減少させた。
操作Ⅱ 容器の容積を1.0Lに保ち,容器内の温度を20℃から100℃に上昇させた。
【高校化学】炭化水素の構造決定【毎週土曜日16時更新!】

単元:
#化学#有機#有機化合物の特徴と構造#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
(1)フマル酸とマレイン酸は,どちらも分子式C₄H₄0₄で表される2価のカルボン酸であり,フマル酸はトランス形,マレイン酸はシス形である。それぞれの構造式を示せ。
(2)分子式C₆H₁₀で表される直鎖状の化合物には,図に示す2 , 4ーへキサジェンがある。この化合物には,シスートランス異性体が存在する。考えられるシスートランス異性体の構造式をすべて示せ。
(3) Lーグルタミン酸の構造式を図(後述)に示す。 これに含まれる炭素原子のうち,不斉炭素原子はどれか。番号で答えよ。
(4)Lーグルタミン酸と鏡像異性体の関係にあるD-グルタミン酸の構造式を図にならって示せ。
この動画を見る
(1)フマル酸とマレイン酸は,どちらも分子式C₄H₄0₄で表される2価のカルボン酸であり,フマル酸はトランス形,マレイン酸はシス形である。それぞれの構造式を示せ。
(2)分子式C₆H₁₀で表される直鎖状の化合物には,図に示す2 , 4ーへキサジェンがある。この化合物には,シスートランス異性体が存在する。考えられるシスートランス異性体の構造式をすべて示せ。
(3) Lーグルタミン酸の構造式を図(後述)に示す。 これに含まれる炭素原子のうち,不斉炭素原子はどれか。番号で答えよ。
(4)Lーグルタミン酸と鏡像異性体の関係にあるD-グルタミン酸の構造式を図にならって示せ。
海外でバズっているイヤーキャンドルの闇を暴きました

【旧センター試験化学】2018追試 第7問 問2 グルコースの燃焼とアルコール発酵

みんな騙されているかも?

【旧センター試験化学】2018追試 第7問 問1 グルコースとセルロース

単元:
#化学#大学入試過去問(化学)#化学(高分子)#糖類#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
問1 デンプンとセルロースに関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① デンプンは、α-グルコースが縮合重合した高分子化合物で、らせん状の構造をもつ。
② デンプンは、希硫酸を加えて加熱すると加水分解される。
③ セルロースは、β-グルコースが縮合重合した高分子化合物で、直線状の構造をもつ。
④ 銅アンモニアレーヨンとビスコースレーヨンは、いずれも繰り返し単位の構造がセルロースとは異なる。
この動画を見る
問1 デンプンとセルロースに関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① デンプンは、α-グルコースが縮合重合した高分子化合物で、らせん状の構造をもつ。
② デンプンは、希硫酸を加えて加熱すると加水分解される。
③ セルロースは、β-グルコースが縮合重合した高分子化合物で、直線状の構造をもつ。
④ 銅アンモニアレーヨンとビスコースレーヨンは、いずれも繰り返し単位の構造がセルロースとは異なる。
【高校化学】アセチレン【毎週土曜日16時更新!】

単元:
#化学#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
炭化カルシウム(カーバイド)に水を加えると,気体Aが発生する。気体Aは三重結合をもつために反応性が高い。ニッケルNiを触媒に用いて,気体Aに水素を付加させると,化合物Bを経てエタンが生成する。また,気体Aを赤熱した鉄に触れさせると。3分子が重合して化合物Cが生成する。
(1)化合物A,B,Cの物質名を記し,下線部①,②の変化を化学反応式で記せ。
下線部①の反応において,0℃,1,013Pa×10⁵Paで5.6Lの化合物Aを得るために必要な純度85%の炭化カルシウムは何gか。有効数字2桁で答えよ。
(3)メタン,エチレン,アセチレンをそれぞれ区別するには,どのような方法を用いればよいか。使用する試薬,生じる現象,その反応名などを示して説明せよ。
この動画を見る
炭化カルシウム(カーバイド)に水を加えると,気体Aが発生する。気体Aは三重結合をもつために反応性が高い。ニッケルNiを触媒に用いて,気体Aに水素を付加させると,化合物Bを経てエタンが生成する。また,気体Aを赤熱した鉄に触れさせると。3分子が重合して化合物Cが生成する。
(1)化合物A,B,Cの物質名を記し,下線部①,②の変化を化学反応式で記せ。
下線部①の反応において,0℃,1,013Pa×10⁵Paで5.6Lの化合物Aを得るために必要な純度85%の炭化カルシウムは何gか。有効数字2桁で答えよ。
(3)メタン,エチレン,アセチレンをそれぞれ区別するには,どのような方法を用いればよいか。使用する試薬,生じる現象,その反応名などを示して説明せよ。
【旧センター試験化学】2018追試 第5問 問2 天然高分子化合物

単元:
#化学#大学入試過去問(化学)#化学(高分子)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
天然に存在する有機化合物のうち、次の条件a~cをすべて満たす化合物として最も適当なものを、下の①~⑥のうちから一つ選べ。
a 不斉炭素原子を有する。
b ニンヒドリン溶液を加えて温めると呈色する。
c 水溶液では、その分子の電荷が全体としてゼロとなるpHの値が5より大きい。
① アラニン
② ガラクトース
③ グリシン
④ グルコース
⑤ グルタミン酸
⑥ フルクトース
この動画を見る
天然に存在する有機化合物のうち、次の条件a~cをすべて満たす化合物として最も適当なものを、下の①~⑥のうちから一つ選べ。
a 不斉炭素原子を有する。
b ニンヒドリン溶液を加えて温めると呈色する。
c 水溶液では、その分子の電荷が全体としてゼロとなるpHの値が5より大きい。
① アラニン
② ガラクトース
③ グリシン
④ グルコース
⑤ グルタミン酸
⑥ フルクトース
【テーマ別解説】化学・入試に出る白色沈殿

有機化学基礎演習16 アルキンC₄H₆と付加反応後の異性体の数

単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#理科(高校生)
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
(問題) 分子式がC4H6で示されるアルキンには( 2 or 3 ) 種類の構造異性体が存在する。また、C4H6のアルキンに1分子の臭化水素HBrを付加させたときに生じる分子式がC4HBrで示される化合物には、シスートランス異性体を含め(5 or 6 ) 種類の構造が考えられる。
この動画を見る
(問題) 分子式がC4H6で示されるアルキンには( 2 or 3 ) 種類の構造異性体が存在する。また、C4H6のアルキンに1分子の臭化水素HBrを付加させたときに生じる分子式がC4HBrで示される化合物には、シスートランス異性体を含め(5 or 6 ) 種類の構造が考えられる。
【高校化学】付加反応【毎週土曜日16時更新!】

単元:
#化学#有機#有機化合物の特徴と構造#理科(高校生)
教材:
#中高教材#セミナー化学基礎・化学
指導講師:
理数個別チャンネル
問題文全文(内容文):
(1)ある炭化水素を0℃,1,013×10⁵Paで3.0Lとって完全燃焼させたところ,同温同圧で9.0Lの二酸化炭素が得られた。また,炭化水素3.0Lに水素を付加させると,同温同圧で6.0Lの水素が吸収された。この炭化水素の分子式を次から選べ。①C₂H₂ ②C₂H₄ ③C₃H₄ ④C₃H₆ ⑤C₄H₆ ⑥C₄H₈
(2)5.60gのアルケンCH₂に臭素Br₂を完全に反応させたところ,3.76gの化合物CH₂Br₂を得た。このアルケンの炭素数nを次から選べ。
①1 ②2 ③3 ④4 ⑤5 ⑥6
この動画を見る
(1)ある炭化水素を0℃,1,013×10⁵Paで3.0Lとって完全燃焼させたところ,同温同圧で9.0Lの二酸化炭素が得られた。また,炭化水素3.0Lに水素を付加させると,同温同圧で6.0Lの水素が吸収された。この炭化水素の分子式を次から選べ。①C₂H₂ ②C₂H₄ ③C₃H₄ ④C₃H₆ ⑤C₄H₆ ⑥C₄H₈
(2)5.60gのアルケンCH₂に臭素Br₂を完全に反応させたところ,3.76gの化合物CH₂Br₂を得た。このアルケンの炭素数nを次から選べ。
①1 ②2 ③3 ④4 ⑤5 ⑥6
【旧センター試験化学】2018追試 第5問 問1 高分子化合物の構成元素

単元:
#化学#大学入試過去問(化学)#化学(高分子)#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
3種類の元素でできている合成高分子化合物を、次の①~⑤のうちから一つ選べ。
① ナイロン 6
③ ポリアクリロニトリル
⑤ ポリプロピレン
② ブタジエンゴム
④ ポリスチレン
この動画を見る
3種類の元素でできている合成高分子化合物を、次の①~⑤のうちから一つ選べ。
① ナイロン 6
③ ポリアクリロニトリル
⑤ ポリプロピレン
② ブタジエンゴム
④ ポリスチレン
1分で解いてほしい化学計算問題 (65) メタンの燃焼

単元:
#化学#化学基礎2ー物質の変化#大学入試過去問(化学)#共通テスト#化学変化と化学反応式
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
メタンCH4を完全燃焼させたところ、18gの水H₂Oが生成した。このとき、生成した二酸化炭素CO2は何gか。最も適当な数値を、次の①~⑤ のうちから一つ選べ。(原子量H1C120 16)
① 9.0② 22 ③33 ④44 ⑤88
この動画を見る
メタンCH4を完全燃焼させたところ、18gの水H₂Oが生成した。このとき、生成した二酸化炭素CO2は何gか。最も適当な数値を、次の①~⑤ のうちから一つ選べ。(原子量H1C120 16)
① 9.0② 22 ③33 ④44 ⑤88
【旧センター試験化学】2018追試 第4問 問5 有機合成の実験装置
単元:
#化学#有機#大学入試過去問(化学)#有機化合物の特徴と構造#理科(高校生)#センター試験
指導講師:
ぺんぎん高校化学問題集
問題文全文(内容文):
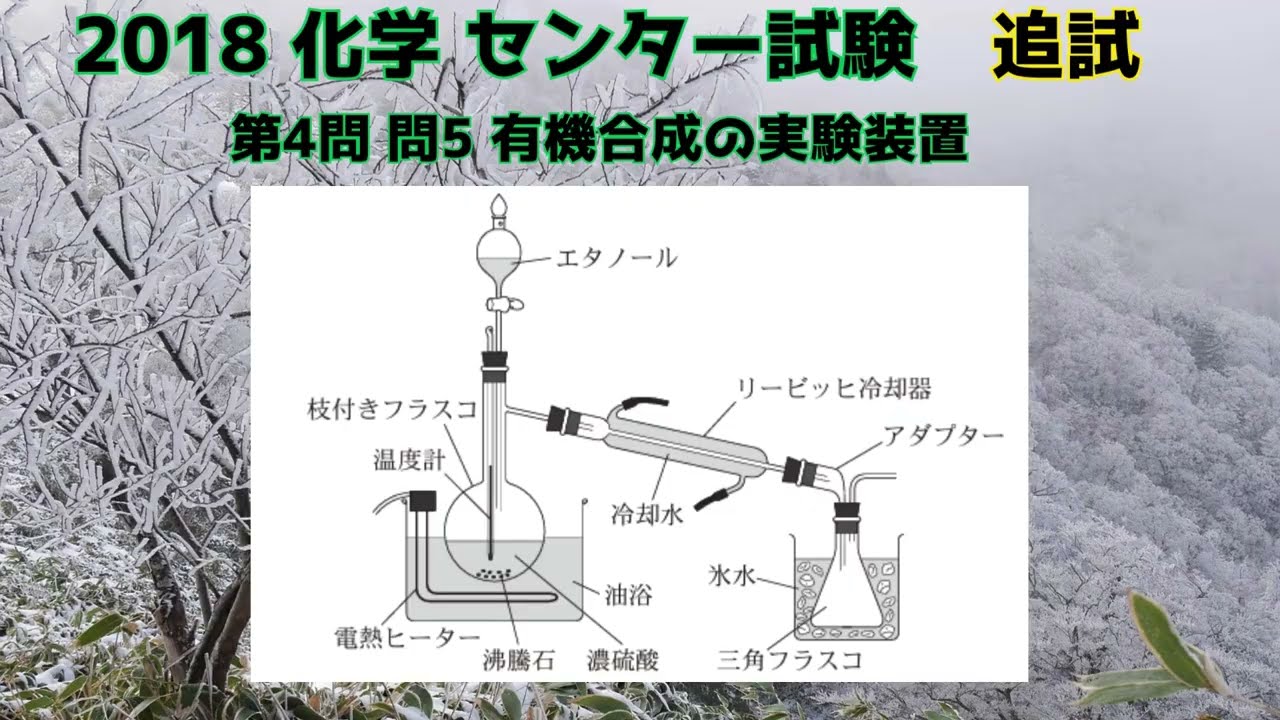
図1は、エタノールから化合物を合成するための実験装置である。枝付きフラスコに濃硫酸と沸騰石を入れ、ここにエタノールを滴下した後、混合物を油浴で約140℃に加熱したところ、化合物が氷水で冷やした三角フラスコに捕集された。この実験に関する記述として誤りを含むものを、下の①~⑤ のうちから一つ選べ。
①油脂を加熱するのにガスバーナーではなく電熱ヒーターを用いたのは、エタノールと化合物への引火を防ぐためである。
②フラスコ内の濃硫酸に沸騰石を入れたのは、突発的な沸騰を防ぐためである。
③リービッヒ冷却器には下から上に冷却水を流した。
④化合物Aは、同じ分子式をもつアルコールよりも沸点が高い。
⑤化合物Aは、エタノール2分子が総合してできた化合物である。
この動画を見る
図1は、エタノールから化合物を合成するための実験装置である。枝付きフラスコに濃硫酸と沸騰石を入れ、ここにエタノールを滴下した後、混合物を油浴で約140℃に加熱したところ、化合物が氷水で冷やした三角フラスコに捕集された。この実験に関する記述として誤りを含むものを、下の①~⑤ のうちから一つ選べ。
①油脂を加熱するのにガスバーナーではなく電熱ヒーターを用いたのは、エタノールと化合物への引火を防ぐためである。
②フラスコ内の濃硫酸に沸騰石を入れたのは、突発的な沸騰を防ぐためである。
③リービッヒ冷却器には下から上に冷却水を流した。
④化合物Aは、同じ分子式をもつアルコールよりも沸点が高い。
⑤化合物Aは、エタノール2分子が総合してできた化合物である。
